质量管理
-
2025.01.09
国际医疗器械展览会|研发质量管理 | 浅谈医疗器械设计验证
研发阶段质量管控的2把利剑,一把是设计评审,另一把是设计验证(DVT, Design Verification test )。国际医疗器械展览会将持续关注医疗器械设计验证的问题。
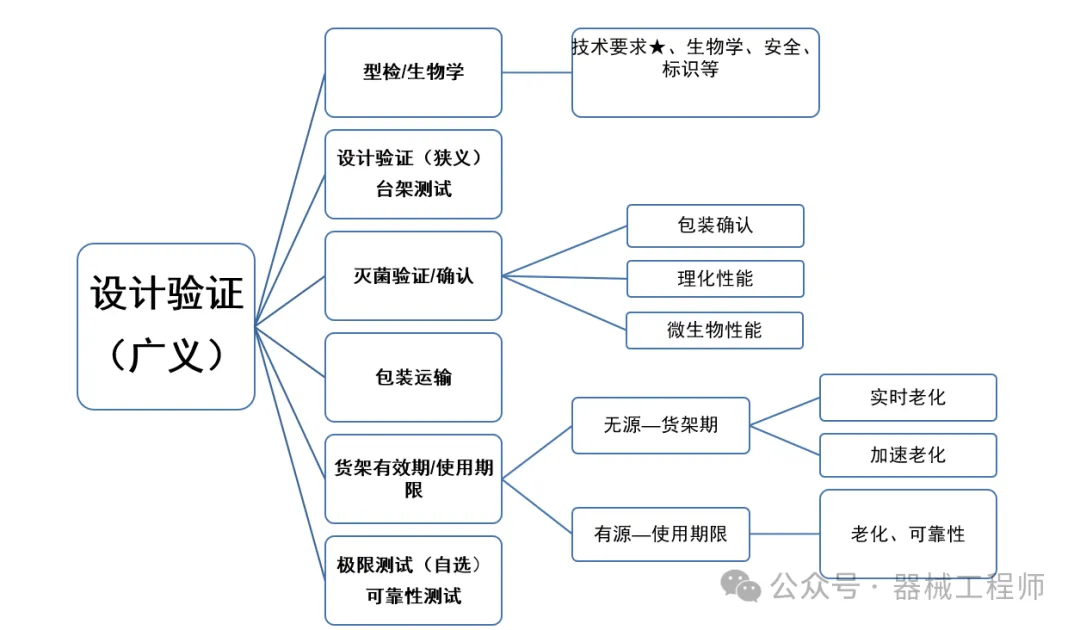
阅读更多 -
2025.01.08
中国医疗器械博览会|医疗器械设计输出精解:确保产品从研发到生产的无缝衔接
设计开发总共涵盖八大模块,而本期内容将聚焦于如何有效地实现设计输出,并确保其符合ISO13485标准及《医疗器械生产质量管理规范》的要求。
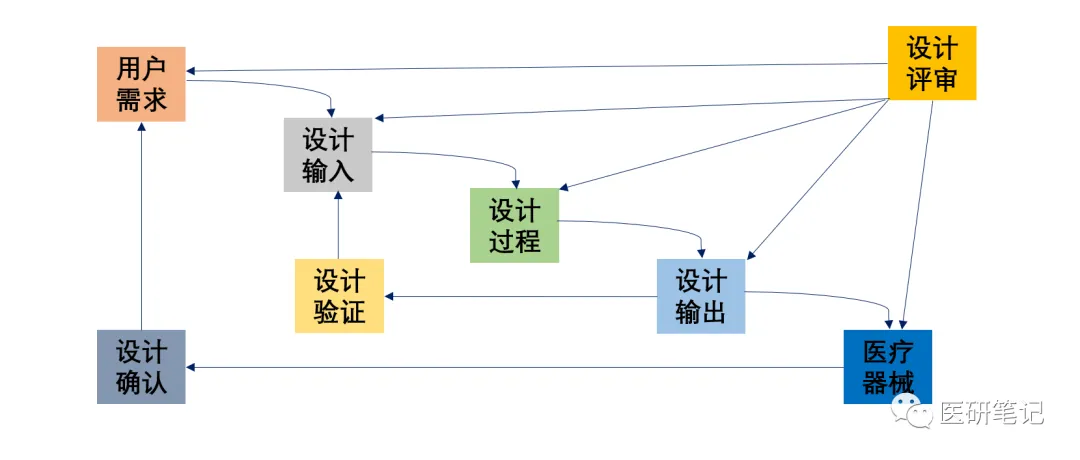
阅读更多 -
2025.01.03
2025上海高端医疗设备展Medtec谈影响质量和注册的”医疗器械生物相容性”,这8个问题讲透了!
阅读更多 -
2024.12.19
2025上海高端医疗设备展Medtec谈研发质量管理| 浅谈医疗器械设计评审
真正的评审可以分为技术评审以及决策评审,两者同属评审,两者都要抓、都要硬。技术评审(TR,technical review)目的是满足客户需求,是斩断设计缺陷的利剑。决策评审(DCP,Decision check point)确认能否实现商业化目标,给企业带来投资收益。
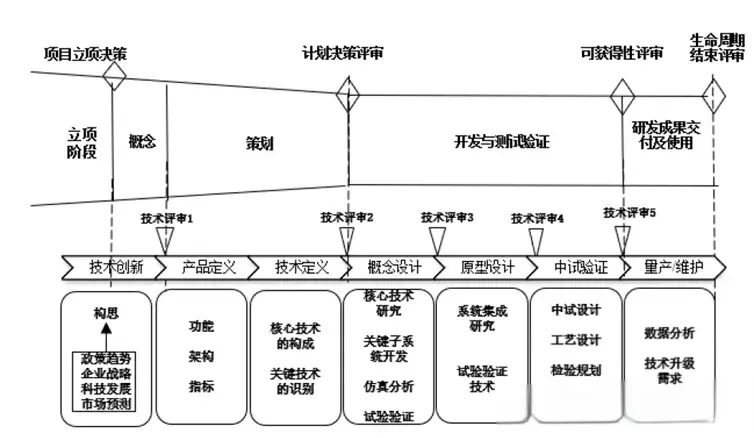
阅读更多 -
2024.12.18
国际医疗器械展览会Medtec分析干热灭菌和湿热灭菌有何区别?如何选择?
阅读更多 -
2024.12.17
2025上海医疗设备展Medtec一文了解FDA关于医疗器械的唯一设备标识(UDI)
PART 830—唯一设备标识(UDI) 是美国食品药品监督管理局(FDA)制定的一个法规,旨在为医疗器械创建一个标准化的识别系统。
其主要目标是提高患者安全、简化医疗器械召回、增强设备可追溯性,并提升市场后监管的效果。该法规要求医疗器械贴上唯一标识符,即唯一设备标识(UDI),以确保其在生命周期中可以被追踪和识别
阅读更多 -
2025上海医疗器械创新展Medtec谈医疗器械包材的微粒要求参考的标准
GB 8368-2018《一次性使用输液器重力输液式》
采用污染指数的方式,对不同粒径的粒子进行权重分析。
接受标准:15-25μm的微粒数不超过1个,大于25μm的微粒数不超过0.5个。
阅读更多 -
2024.12.11
2025上海医疗设备展Medtec谈设备全生命周期管理,这一篇讲明白了
阅读更多 -
2025医疗器械展览会Medtec带您了解:欧盟医疗器械除了Basic UDI,竟然还有Master UDI
近日,欧盟MDCG发布《隐形眼镜Master UDI-DI解决方案的实施指南》,在结构、分配、标签和注册等方面为隐形眼镜实施Master UDI-DI规则提供指引

阅读更多 -
2024.12.10
2025上海医疗器械创新展Medtec详解医院医疗器械管理分类大全
医疗器械监督管理条例——中华人民共和国国务院
阅读更多












