质量管理
-
2024.11.04
有源医疗设备展解读高压灭菌锅(压力蒸汽灭菌器)的灭菌效果监测怎么做?
阅读更多 -
2024.11.02
有源医疗设备展解读医疗器械EMC要求概览 1
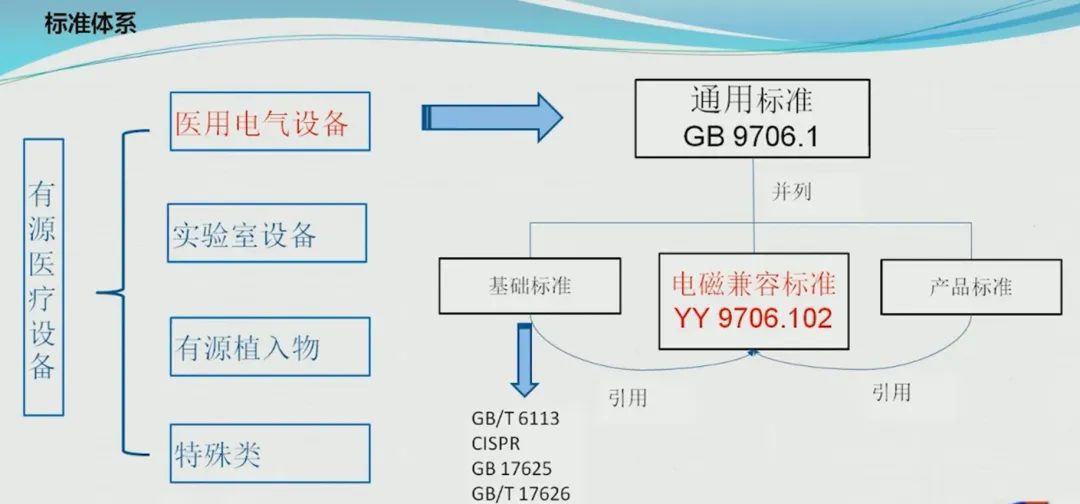
阅读更多 -
2024.10.31
2025上海医疗器械创新展解读:无菌 l 除菌过滤器的压力监测

阅读更多 -
2024.10.30
2025上海医疗器械创新展谈ECA:关于欧盟无菌附录1的问答
阅读更多 -
2024.10.22
2025医疗器械展览会Medtec详解包装运输试验和环境试验
阅读更多 -
2024.10.12
国际医疗器械展览会Medtec详解洁净区的压差控制
阅读更多 -
2024.09.12
上海医疗器械博览会Medtec浅谈医疗器械动物试验设计考虑要点
本文系统性总结了动物试验设计在医疗器械研发中的考虑要点,参考了多份权威文件。内容涵盖动物试验与设计开发的关系、样品要求、对照品选择、样本量设计、方案及报告要求等方面。强调了动物试验在确认医疗器械可行性、安全性和有效性中的作用,并详细说明了可行性研究和安全/有效性研究在设计开发流程中的不同应用。
阅读更多 -
2024.09.11
医疗器械行业展览Medtec干货 | 关于医疗器械实验动物的选择和依据
本文讨论了医疗器械动物试验的重要性、必要性、实验动物的选择以及实验方案设计的复杂性。指出动物试验是确认医疗器械风险控制措施有效性的关键手段,并强调随着监管规范化,越来越多二类医疗器械在注册时也需补充动物实验。
阅读更多 -
2024上海医疗设备展Medtec详解 无菌医疗器械包装质量控制要点(上)
本文全面探讨了无菌医疗器械包装的重要性、材料分类、国内外标准以及质量控制流程。无菌包装作为医疗器械的最后一道防护,需具备阻隔微生物、维持无菌状态及耐受多种灭菌方式的能力。材料上分为纸、聚烯烃非织造布、塑料膜、玻璃等,包装形式则多样。
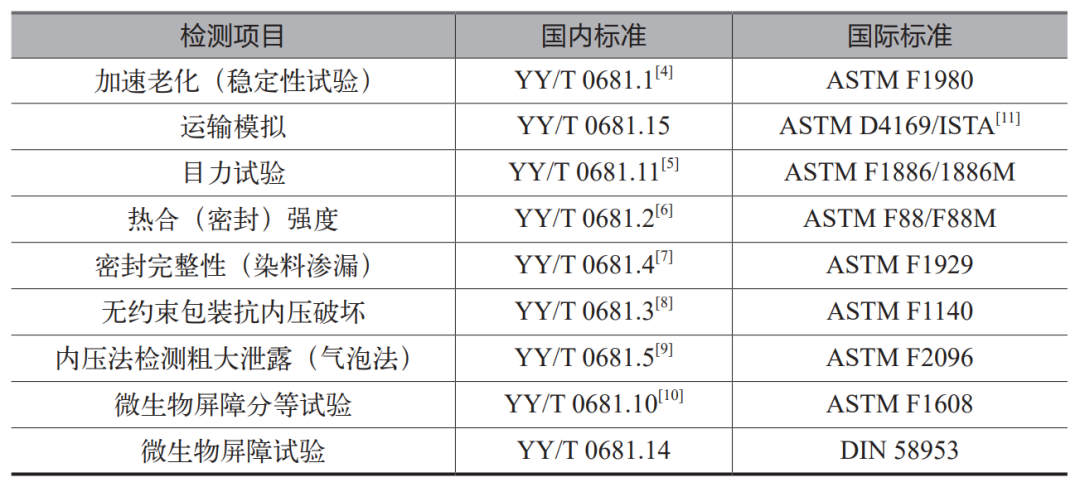
阅读更多 -
2024.09.03
2024医疗器械展会Medtec简述医械生物相容性评价的目标和方法
医疗器械生物相容性评价是确保其临床安全有效的关键,需贯穿产品全生命周期,综合考虑材料、工艺、降解产物等因素,方法需不断更新。
阅读更多












