质量管理
-
2024.09.03
2024医疗器械展会Medtec简述医械生物相容性评价的目标和方法
医疗器械生物相容性评价是确保其临床安全有效的关键,需贯穿产品全生命周期,综合考虑材料、工艺、降解产物等因素,方法需不断更新。
阅读更多 -
2024.09.01
上海医疗器械博览会Medtec解析 仪器校准中正确度、精确度、精密度有什么区别?分别是什么定义?
计量中的正确度指测量值与真值的差距,精确度反映测量值与标准值的差距,精密度则体现多组测量数据之间的数值误差。三者各有定义。
阅读更多 -
2024.08.31
医疗器械行业展览Medtec视角 | 医疗器械生物相容性简介、流程、路径和数据
医疗器械生物相容性评价是确保产品安全性和有效性的重要环节,涉及全面评估生物学反应和风险,需遵循相关标准和法规进行评价。
阅读更多 -
2024.08.29
上海医疗器械展会Medtec谈医疗器械原材料变更的基本流程
本文讨论了医疗器械原材料变更的重要性及其基本流程,包括识别变更形式、变更研究内容、风险分析、通知第三方、上市后监测等,强调变更需受控并按流程评估。
阅读更多 -
国际医疗器械展览会Medtec谈MDR和FDA的器械可用性测试
本文中国际医疗器械展览会Medtec讨论了医疗器械可用性验证的重要性,指出测试应涵盖所有操作设备的人员,并详细介绍了可用性工程报告的要求。

阅读更多 -
2024.08.27
2024医疗器械展览会Medtec解析医疗器械生产组织的质量管理体系需满足的四方面要求
医疗器械生产组织的质量管理体系需满足四大要求:一是遵循GB/T42061标准,涵盖从设计到生产各阶段的质量管理;二是遵守国家和地方法规,确保产品安全合规;三是满足顾客对性能、质量、交付和服务的期望;四是符合组织自身发展目标,提升效率和竞争力。2024医疗器械展览会Medtec将聚焦市场趋势,提供交流平台,助力企业优化质量管理体系。
阅读更多 -
2024.08.26
2024上海医疗器械创新展Medtec谈GB9706医疗器械强制标准,离不开这5大问题!
2024上海医疗器械创新展Medtec带您读懂GB9706.1-2020标准的适用范围、对医疗器械注册备案的要求、企业在执行标准时面临的常见问题,特别是风险管理在产品设计开发过程中的重要性和具体要求。
阅读更多 -
2024.08.22
2024医疗器械展会Medtec解读以标准化助力体外诊断行业高质量发展
在新冠肺炎疫情暴发后,IVD行业作为疾病筛查和诊断的主力先锋站到了抗击疫情的第一线。近十年来,IVD医疗器械行业迎来了全方位高速增长期。2024医疗器械展会Medtec认为,IVD医疗器械标准化工作是推动IVD行业有序、快速、高质量发展不可或缺的一环。
阅读更多 -
2024.08.20
2024医疗器械展会Medtec无源医疗器械安全性评价第二部分:货架有效期
医疗器械注册阶段,货架有效期部分研究至关重要,货架有效期研究是确保产品在规定期限内能够正常发挥预期功能的重要证据。当医疗器械超过货架有效期研究规定的最大期限,器械的性能可能无法得到保证,在使用时则存在潜在风险。
阅读更多 -
2024.08.19
医疗器械制造展Medtec医疗器械可用性要求概述
ISO 62366在医疗器械的设计过程中扮演着重要的角色,因为它解释了与可用性相关的要求。可用性研究是设计历史文件的重要组成部分。
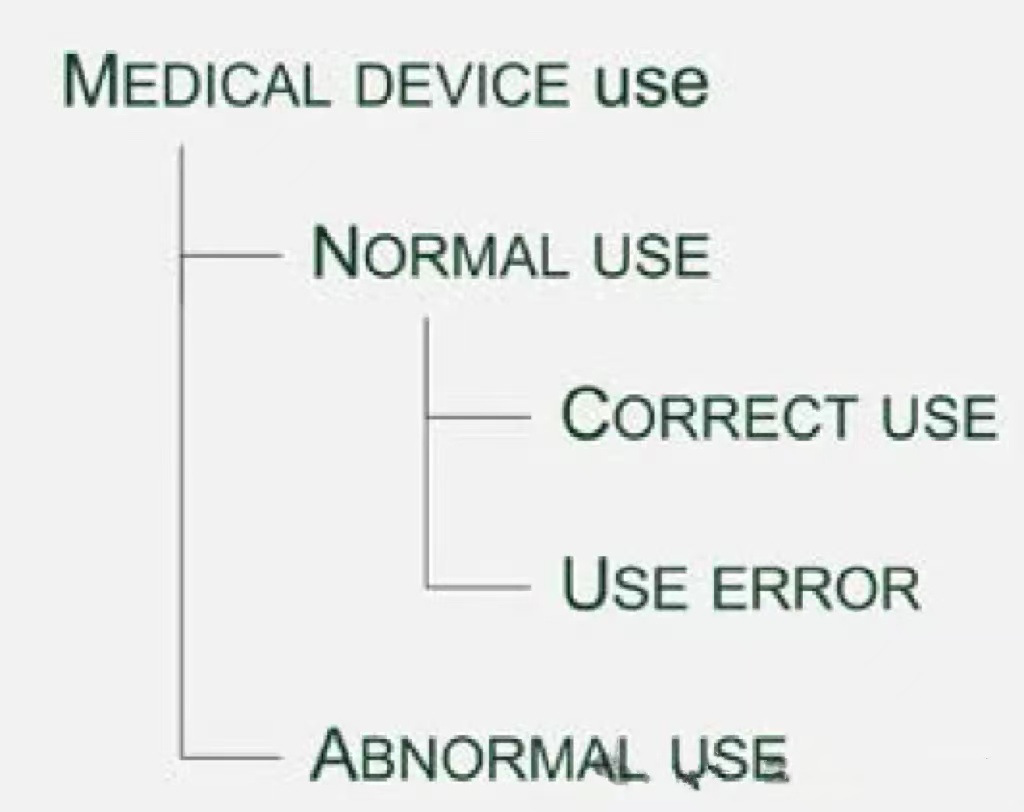
阅读更多












