质量管理
-
2024.07.09
2024上海医疗器械创新展Medtec解读医疗器械设计验证中的稳定性测试:关键要素与实践
医疗器械的安全性和有效性是医疗健康领域的核心关注点。设计验证是确保医疗器械满足预期使用要求的关键步骤,而稳定性测试则是设计验证中的重要组成部分。本文旨在分享稳定性测试的重点方面,以及如何在实际工作中进行有效实施。
阅读更多 -
2024.07.01
上海医疗器械展会Medtec谈设计变更的质量管理实践
设计变更是一个关键的医疗器械质量管理体系中的环节,需要我们采取适当的步骤,确保变更的安全性、有效性以及符合法规要求。结合以往实战经验,上海医疗器械展会Medtec提供以下是一些实施建议,期望可以帮助我们在设计变更活动中做得更好:
阅读更多 -
2024.06.30
国际医疗器械展览会Medtec谈医疗器械的设计转换
设计转换,顾名思义,或通俗的理解,是将设计(研发端)转向制造(运营端),但需要理解的是,并不是说运营端(某些时候部分同行可能会理解成仅仅是生产部)可以按SOP生产就算是完事了。另外,国际医疗器械展览会Medtec认为在与同行间接或直接交流设计转换的话题时,常常提及到的还有转换的时机,在什么阶段进行。

阅读更多 -
2024.06.25
上海医疗器械博览会Medtec浅谈医疗器械的验证(Verification)与确认(Validation) (上)
上海医疗器械博览会Medtec结合自身多年来在医疗器械行业的学习、实践和感悟,尝试浅谈在医疗器械行业的V&V,供医疗器械从业者们学习,借鉴,分享。
阅读更多 -
【2024上海医疗设备展Medtec学习】医疗器械消毒灭菌方法选择原则
2024上海医疗设备展Medtec今天来为大家解读医疗器械消毒灭菌方法选择原则,将从要求、区别等多方面进行讲解。
阅读更多 -
2024.06.24
2024医疗器械展会Medtec教你怎么选择无菌器械的无菌保证水平
2024医疗器械展会Medtec借此文提供了为医疗器械选择适当无菌保证水平(SAL)的信息。无菌保证水平(SAL)仅适用于最终灭菌工艺(例如湿热、环氧乙烷、辐射灭菌、汽化过氧化氢)。这一选择涉及许多因素,但由于SAL的选择与灭菌剂量直接相关,因此这一决定对于任何产品的无菌声明都至关重要,必须考虑对产品设计的影响(材料选择、客户需求和愿望、功能等)。
阅读更多 -
2024.06.18
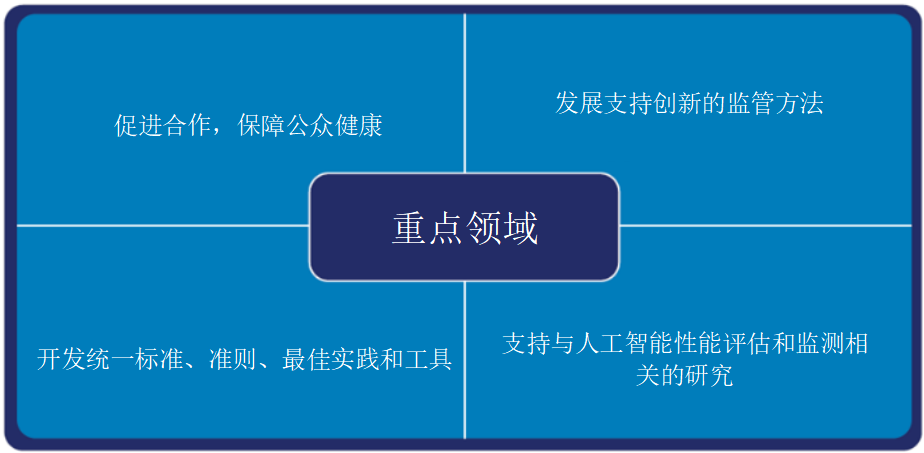
2024上海医疗设备展Medtec独家专文 | FDA介绍人工智能监管方法的四个重点
美国食品药品监督管理局(FDA)在监管医疗器械中的人工智能(AI)技术时,将采取多部门协同的方式。3月15日,FDA发布了一份名为《人工智能与医疗产品:CBER、CDER、CDRH和OCP的携手合作》的报告。报告阐述了FDA医疗产品中心将如何在保护公众健康的同时,推动医疗产品及开发中AI技术的创新。
阅读更多 -
2024.06.17
国际医疗器械展览会Medtec解答“我应该先申请 EU MDR, 还是 FDA 510(k)?
我是一家医疗器械制造商,正在生产一种新的医疗器械。我应该先申请CE标识(MDR)还是FDA许可(510(k))?
阅读更多 -
2024.05.28
上海医疗器械展会Medtec解读植入性医疗器械生产过程中的设备要求
上海医疗器械展会Medtec特意查阅了《医疗器械生产质量管理规范 附录 植入性医疗器械》(以下简称《附录》)“2.4设备”对植入性医疗器械生产过程中的设备、装备、器具、工艺用水等提出了要求。
阅读更多 -
2024.05.21
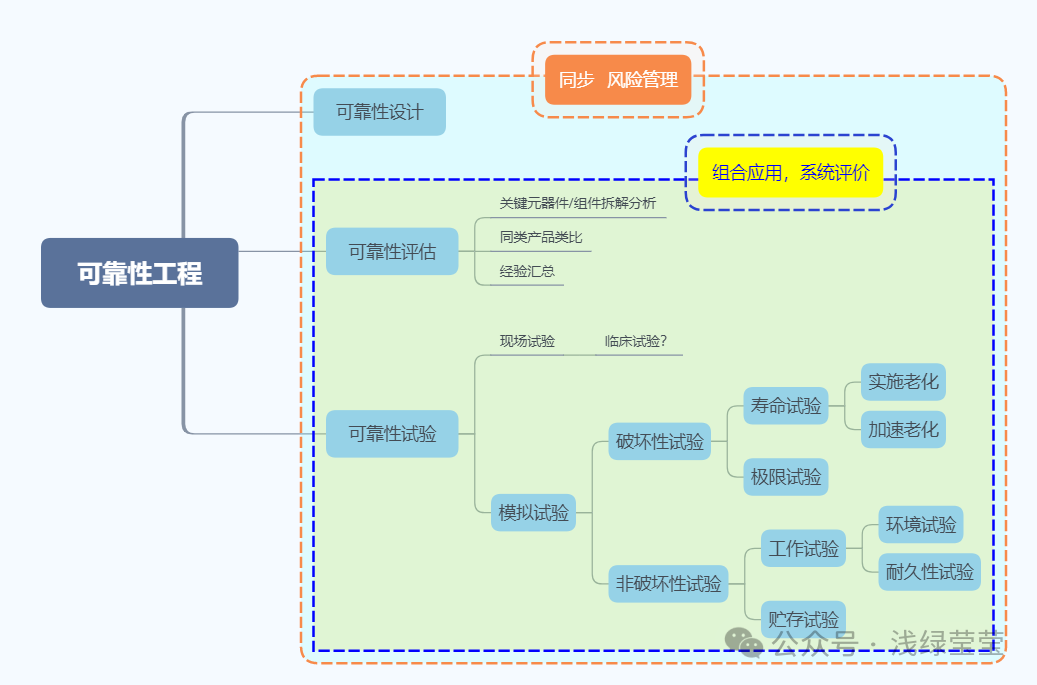
2024上海医疗器械创新展Medtec浅谈医疗器械使用期限到可靠性的距离
2024上海医疗器械创新展Medtec先考虑了可靠性的概念。在这个概念里,有很多非医疗器械领域可靠性的测试及试验,包括环境试验(类似GB 14710的部分内容)、机械应力试验(跌落、包装运输等)、寿命试验(插拔、折叠、)、表面处理层测试(诸如清洁消毒的影响)!信息很丰富,借鉴意义很大。
阅读更多












