法规政策
-
2019.02.25
国外医疗器械注册审评项目管理人制度研究及启示
span style=”font-weight:normal;”>2017年,中共中央办公厅和国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,其中要求完善医疗器械注册审评项目管理人制度。笔者比较了美国、欧盟审评机构对项目管理的组织结构设计,验证了不同组织结构对我国审评机构的适用性,认为以专业为导向、兼顾效率的组织结构更加适用于我国。
阅读更多 -
更新生物相容性测试方法的另一个理由:欧盟新医疗器械法规
本文中化学和生物相容性领域的专家Matthew Jorgensen博士分享了在医疗器械生物相容性方面的最新见解和预测。

阅读更多 -
2019.02.22
终于搞懂生物相容性标准 ISO 10993-1:2018
span style=”font-weight:normal;”>新版生物相容性标准ISO10993-1:2018,特别是大家所熟知的生物相容测试参考清单附录A的整体更新,以及附录B生物风险管理整体引入ISO TR 15499的更新等,将对医疗器械生产商、注册人及各检验机构产生结构性的影响。
阅读更多 -
2019.02.19
浅析医疗器械独立软件描述文档编制要点
《医疗器械软件注册技术审查指导原则》要求独立软件应提供软件描述文档,文章将对独立软件在软件描述文档编制中的要点进行浅析。
阅读更多 -
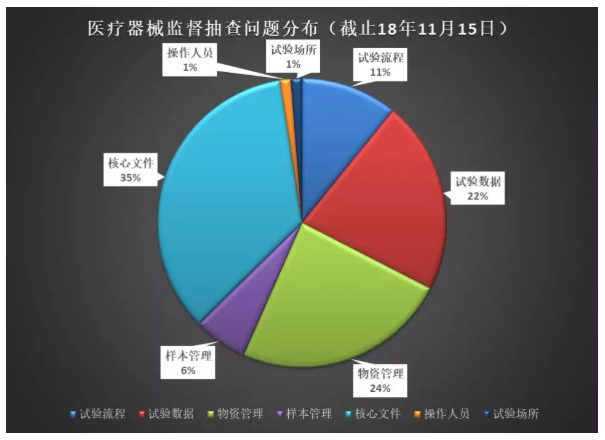
器械临床试验核查问题分析及常见问题汇总
2019年已经正式拉开帷幕,回想过去的一年,我司接受了某省局、国家局对于临床试验两次监督抽查,小编与队友们回忆往昔,以切身经验为基础,对2016年至今2018年总局三年内的医疗器械临床抽检公告进行了总结。
阅读更多 -
2019.02.18
2018年创新医疗器械产品审评审批状况
从国家药监局获悉,截至2018年12月31日,已有197个产品进入创新医疗器械特别审查通道,该局已批准神经外科手术导航定位系统、正电子发射断层扫描及磁共振成像系统等54个产品注册,一批创新性强、技术含量高、临床需求迫切的创新产品上市,填补了相关领域的空白,更好地满足了人民群众的健康需求。

阅读更多 -
2019.01.31
医疗器械现场检查中,要避开这些“坑”
2014年国家发布了《医疗器械生产质量管理规范》(以下简称规范),2015年发布《医疗器械生产质量管理规范附录无菌医疗器械》、《医疗器械生产质量管理规范附录植入性医疗器械》和《医疗器械生产质量管理规范附录体外诊断试剂》。为确保规范的有效实施,国内各省市开始依据规范及其相关附录,进行注册环节的现场检查。
阅读更多 -
2019.01.28
美国发布2019年医疗器械指南制修订计划
美国食品药品管理局(FDA)医疗器械和放射健康中心(CDRH)近期提出了2019年医疗器械指南的制修订计划,包括制定新指南和对已发布指南进行回顾性审查。 据了解,为促进安全有效的
阅读更多 -
2019.01.16
年终盘点|2018年医疗器械监管大事纪
2018年是医疗器械审评审批制度改革持续深化的关键之年,相关政策法规密集出台,并呈现出宽严相济的趋势。

阅读更多 -
2019.01.15
2018年创新医疗器械特别审批与医疗器械优先审批情况
2018全年,共有50个医疗器械获得创新医疗器械资格认定并进入特别审批程序,另有19个创新医疗器械成功获批上市;2018全年还有11个医疗器械被纳入医疗器械优先审批程序,另有3个成功通过优先审批程序上市。

阅读更多












