法规政策
-
2018.06.25
境内外法规检查的过程比较, 对中国制造业准备FDA检查的启示
无论是FDA对中国制造业的检查,还是CFDA的海外检查,对于检查和被检查的双方来说都有一个认知和熟悉的过程,这个过程的长短几乎可以决定检查过程是否能够顺利得进行,很大程度上也决定了检查结果的好坏。
阅读更多 -
2018.06.22
“欧美准备CFDA检查”带给“中国制造商准备FDA检查”的启示
018年在年初经历了美国政府停摆,FDA取消检查,过门而不入,让中国制造商进不是,退也不得的尴尬境地之后, 最近有机会替欧美的顶级制造商准备将要到来的中国FDA的检查,

阅读更多 -
2018.06.11
中国实施国际统一的唯一器械标识(UDI) 进一步促进全球范围的医疗器械上市后监管
为了加强医疗器械全球上市后监管,促进追溯管理效率提高,全球形成了唯一器械标识(UDI)的协调方案,美国和欧洲也都开始进入实施准备阶段。针对中国地区如何实施的问题,文章介绍了UDI的产生和建立的基本原则,比较了国内药品电子监管实施的差异,提出通过走国际化协调的道路,来解决中国医疗器械UDI的实施,更有利于中国监管和产业发展。

阅读更多 -
2018.06.06
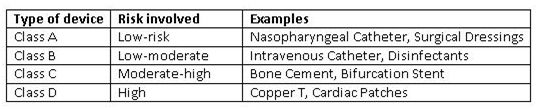
印度医疗器械监管重点
本文分析了印度《医疗器械法规2017》的主要特点,旨在探讨其对印度医疗器械行业发展的影响。
阅读更多 -
2018.05.29
浅析医疗器械产品技术要求
文章介绍了医疗器械产品技术要求的产生,产品技术要求与产品注册标准的区别。梳理了产品技术要求所涉及的医疗器械各个环节,分析讨论了医疗器械产品技术要求对于整个医疗器械全周期的重要性。
阅读更多 -
2018.05.24
器审中心公开8个技术审评报告
为了全面贯彻落实国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)文件精神,提高审评审批透明度,器审中心自2017年12月至2018年4月,共公开8份《医疗器械产品技术审评报告》。
阅读更多 -
2018.05.23
政策解读 | 创新医疗器械特别审批程序(修订稿征求意见稿)
2018年5月7日,国家药品监督管理局发布了关于公开征求《创新医疗器械特别审批程序(修订稿征求意见稿)》从修订内容看,与原试行程序相比,更加科学合理。跟小编一起来看看都有哪些变化和注意事项吧。

阅读更多 -
2018.05.22
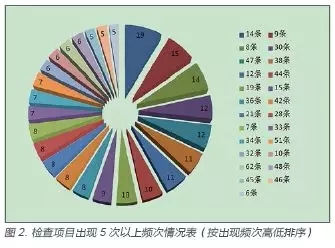
2017 年医疗器械经营企业飞行检查主要问题分析
目的:了解国内医疗器械经营企业质量管理体系飞行检查缺陷项目情况,找出企业存在的主要问题,提出加快推进落实经营质量管理规范的相关要求的对策和建议。方法:对国内2017 年经营企业飞行检查的30 家企业的缺陷项目进行汇总,对主要问题进行分类、归纳。结果与结论:应严格执行规定,加大培训力度,建立专职检查员队伍,妥善处理善后问题,确保规范得到正确贯彻实施。
阅读更多 -
2018.05.15
【国家药监局】冠状动脉药物洗脱支架临床前研究及临床试验两个指导原则发布
国家药品监督管理局关于发布冠状动脉药物洗脱支架临床前研究及临床试验两个指导原则的通告(2018年第21号) 为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量。
阅读更多 -
2018.04.28
医疗器械企业自己开展试验还是外包给CRO?
国内部分企业自己开展临床试验,由于企业有多年的临床试验经验,公司持续有新产品,公司有临床试验团队。但很多大公司机制繁冗,虽然有项目,但并不多。基本是一个经理,带几个员工全都承包了,并没有医学、临床、培训、监督等分工,没有明确的推动机制。
阅读更多












