上海医疗器械展会深度剖析:注射组合产品的容器封闭完整性(CCI) 整体方法
2023-12-15
摘要
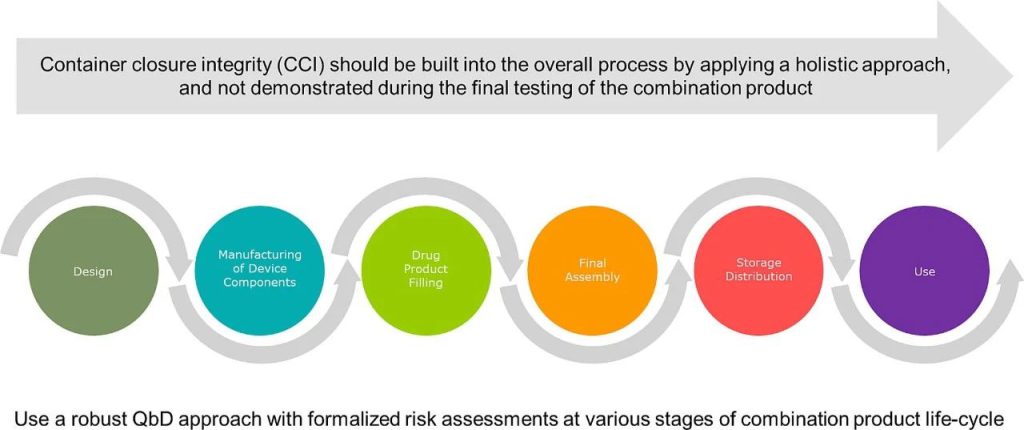
生物制剂越来越多地被开发为与给药装置结合的注射组合产品。对于此类医疗器械在其整个生命周期中保持无菌至关重要。因此,容器封闭完整性(CCI)最好应纳入整个过程,而不仅仅是在组合产品的最终测试来证明。完整性是一个重要的关键质量属性 (CQA),并且在组合产品生命周期期间的具体考虑和研究范围内,即设计稳健性、组装过程、存储(至保质期结束)和患者使用前的运输。
本文的目标是总结一种行业整体方法,以确保组合产品的 CCI,并为质量(就 CCI 而言)构建到整个流程中建立科学依据。本文上海医疗器械展会Medtec China会提及组合产品开发中用于表征或GMP中CCI 测试的相关分析方法。然而,在产品开发过程中使用质量源于设计 (QbD) 可以减少或消除组合产品的常规批次水平或稳定性测试。
介绍
行业很明显的趋势是生物制剂正在与给药装置一起作为药械组合产品来开发,并且变得越来越复杂。此类装置包括预充式注射器(PFS)、安全注射器、移动装置、自动注射器、笔式注射器、贴片注射装置和可穿戴注射装置(OBDS) 或其他基于针头的注射装置(NIS)。
将生物制剂集成到给药装置的主要驱动因素是提高患者安全性、降低、或更高剂量以及更容易配药。
有各种监管指导文件、测试方法、ISO规范和设计控制信息可用于开发药械组合产品,范围从特定医疗器械信息,以PFS 或自动注射器(AI)为例,到组合产品的上市前路径到生命周期管理。
在组合产品开发过程中,质量源自设计 (QbD) 可以作为一个强大工具,其原理可用于全面评估各个重要方面,例如从无菌保障到终端使用。注射剂容器封闭系统 (CCS) 的容器封闭完整性(CCI)和/或最终灭菌的医疗器械初级和次级包装系统的无菌屏障间隙(SBI)需要在整个产品开发过程中受到严格控制,并在制药公司的日常生产过程中得到验证。
CCI最好应该通过构建到整个过程中,而不仅仅是在组合产品的最终测试过程进行确认,这种理念应该可以通过对组合产品的整个生命周期 CCI 采用整体方法得以实现。对于作者来说,整体方法应考虑容器封闭性的所有相互关联的方面,而不是特定的部分/方面,并包含控制策略的所有要素。
控制策略是在整个产品生命周期中建立的,从产品设计到保质期稳定性,必须解决所有风险以及如何预防和控制它们。同样重要的是,对CCI的各个方面都有全面且适当的了解,以确保患者安全。
尽管网上有关于给药装置 CCI 整体方法的文章和CCIT 检测仪器商的应用说明,但据我们所知,目前还没有已发表的同行评审研究文献,或者是基于多家公司立场共同提出的行业广泛观点。本文献的目的是提出与阐述医疗器械 CCI 的整体方法,该方法可在行业内使用,以证明给药装置设计的稳健性、组合产品的装配过程、存储到产品患者终端使用前的保质期和运输。
该整体方法将以基于PFS 的自我注射装置(AI)作为案例进行说明。文献提供了合适的分析方法的概述,以及一些具体的案例。这些可用于评估和证明组合产品在生命周期各个阶段的 CCI。由于科学文献非常有限,我们希望本文能够引发科学界、工业界和监管界的进一步讨论。
注射组合产品不仅能做到精准用药、减少错误和交叉感染风险,还能极大提高患者的便利性,尤其是需要多种药物的情况,这有助于提高患者的依从性和治疗效果。为此制造过程是医疗器械创新和改进的推动力,上海医疗器械展会Medtec China致力于为器械生产商和供应商提供交流平台,在上海医疗器械展会Medtec China 2023举办的苏州国际博览中心中,江苏青昀、贝里精英包装、鹏达精密、安姆科中国、上海浦雄实业、北京当盛、南通富华、天长市嘉瑞、卫利国际科贸、苏州欧托维克、苏州依斯倍、高是医疗等企业将带来医疗器械灭菌材料及服务。点击报名参展,了解更多生产制造信息。
部分章节简介
组合产品的概览
注射剂是销量金额最大的药物类型,排在口服制剂前面,注射给药作为肠外用药是迄今为止唯一实用的生物制剂(如单抗)给药途径。首先无菌灌装至西林瓶、卡式瓶或PFS中,然后进一步与给药装置组装成为组合产品来销售。
组合产品生命周期和整体方法的主要要素
组合产品的所需性能需要满足药品(DP)质量目标产品概况 (QTPP) 和器械设计要求。QTPP受 ICH 指南/GMP法规的约束,器械设计要求则受 ISO 标准的约束。提供一个框架来开发和制造始终安全的药物组合产品。药品和设计要求的相关关键质量属性(CQA)和关键材料属性(CMA)在正文有详述。
组合产品 CCI 整体方法的主要阶段
药品通过验证的灭菌过程和对与药品有接触的包装组件进行灭菌后,组合产品是无菌的。对于基于 PFS 的自我注射装置,是没有额外的药液流通路径的,因为护帽和活塞可保护针管内药液直到交付给患者使用。因此,CCI 和/或无菌主要由制剂开发选择 PFS时已有考量,但还应从组合产品层面来考虑一些其他的特定因素。
温度波动
制造和运输过程中预期和允许的温度变化对组合产品 CCI 的影响是验证组合产品批次的 DV 和稳定性测试的一部分。超出这些条件的意外偏移,特别是短暂暴露于极低(≤0 °C)的温度,通常是具体问题具体评估。通常,此类偏差不需要对组合产品测试(例如基于PFS的AI)。
组合产品 CCI 测试的分析方法
已有多种 CCIT 方法可用于注射制剂的相应阶段测试,以保证整个生命周期的CCI,但这些方法不一定适合组合产品,因为可能受到组合产品固有特性的限制,从细微角度来看,可能会造成极大影响该方法的结果,例如内包材 PFS 常装配在次级包装注射装置中,因此测试分析方法需要考虑这些因素。
组合产品终端灭菌的注意事项
医疗器械最终灭菌有自己的标准管理办法,增加了无菌隔离系统(SBS)的概念。SBS 和次级包装系统旨在保持终端灭菌的组合产品或装置部件的无菌状态,组合产品除了考虑药品的 CCIT 外,通常还考虑在 DV 期间进行基于风险的 SBS 测试策略和附加表征研究。
结论
注射组合产品的开发需遵循以患者为中心的一致策略。它们的关键功能之一是提供一个完整的容器,根据其质量目标产品概况来保护药品。这篇文献,据我们所知,是第一篇制药业界关于注射剂药械组合产品 CCI 整体方法的文献。它描述了如何在组合产品的生命周期内确保质量,而不仅仅依赖最终的CCIT。
文章来源:小包服











