中国医疗器械CRO行业研究报告(三)
2018-09-13
本文撰写于2018年6月份,原文首发于MedTrend会员库,较原文略有删减。感兴趣的朋友们欢迎前往医趋势会员库(https://www.tiaonali.com/tnl-member/wechat/trend/candidate/memberbak.page)下载原文,欢迎与作者就器械领域的CRO发展前景与投资标的与作者讨论交流。
原文约35页共计2万字左右,分四次推送,今天推送第三部分,欢迎大家积极关注。
摘要:合同研究组织(ContractResearch Organization,CRO)是20世纪70年代后期在美国兴起的新生组织形式,其最初只是提供数据处理及统计分析的咨询服务组织。80年代,CRO模式首先在医药行业得到广泛应用。目前,在医药医疗行业的CRO公司主要集中在医药领域。在医药CRO市场持续火爆,且投资逻辑完全得到市场验证的情况下,笔者认为医疗器械CRO行业同样值得市场关注。与创新药研发路上的卖水人(医药CRO公司)类似,本质上医疗器械CRO服务也是服务外包的一种形式,依附于医疗器械行业而存在。
受国家鼓励外包产业发展、器械上市许可人制度和国内医疗器械消费水平仍有提升空间利好因素的影响,笔者认为医疗器械CRO行业市场前景将持续获得高速增长。有数据表明,国内医疗器械生产企业以及进口医疗器械贸易企业在中国上市前投入到CRO部分的服务费用大约占其市场销售额的5%左右,以2017我国医疗器械市场规模5000亿元计算,国内医疗器械CRO市场规模也有250亿元人民币,即便是扣除大公司有能力自我注册和和临床部分,行业规模也有百亿级别。
但是,与行业市场容量相对的是,目前,国内医疗器械类CRO 公司数量有数百家之多,但是行业小企业居多,营业收入和盈利能力较差,且无真正的龙头企业诞生,亟需优化整合。伴随着医疗器械行业的发展和法规的变化,CRO公司与客户的粘度变得越来越高,客户对CRO公司的需求,以及CRO公司需要给企业提供的服务,也呈现越来越多元化、越来越精细化的趋势。
全文目录如下:

四、医疗器械CRO行业发展机遇
一直以来,国内医疗CRO企业服务主要集中于医药研究,从事医疗器械的CRO少之又少。但是随着创新医疗器械开启优先审批程序、国产医疗设备品目遴选、医疗器械优先审批程序等一系列政策明确提出大力支持民族品牌和国产器械的发展,加快医疗器械国产化替代,我国医疗器械行业站上了政策的风口。
同时,由于医疗器械产品多样,且缺乏临床规范性,随着器械临床试验规范化改革的加快,企业在医疗器械的审批注册等方面对器械CRO的需求快速上升。政策的利好与旺盛的市场需求将有望带来器械CRO行业的快速发展。由于医疗器械的多样性和临床试验的特殊性,其临床试验方案、指标评估和检查方式都与药品临床试验的特性不同,因此医疗器械CRO行业的潜在进入者及替代产品较小,业务很大程度上依附于需求旺盛的下游医疗器械行业,因此行业内的龙头企业将迎来发展的良机。
4.1、国家积极扶持服务外包行业发展
作为服务外包的重要领域之一,国家一直支持服务外包行业做大做强:
2010年4月7日,国务院办公厅发布了《关于鼓励服务外包产业加快发展的复函》,同意完善杭州等20 个中国服务外包示范城市的政策措施,加大财政资金支持力度,做好与服务外包产业有关的金融工作,为服务外包企业做大做强营造良好环境,加快服务外包人才的培养,推进我国服务外包产业量的扩张和质的提升。
2015年1月16日,国务院印发了《关于促进服务外包产业加快发展的意见》(国发〔2014〕67号),意见指出要培养一批中高端人才、复合型人才和国际型人才,培育一批具有国际先进水平的服务外包知名企业,建设一批主导产业突出、创新能力强、体制机制先行先试的服务外包产业集聚区,同时将中国服务外包示范城市数量从21个有序增加到31个。
2016年6月13日,商务部、财政部、海关总署等三部门发布的《服务外包产业重点发展领域指导目录》,就包括工业设计服务等24个重点发展领域。
图表16.与医疗器械CRO行业密切相关的服务领域
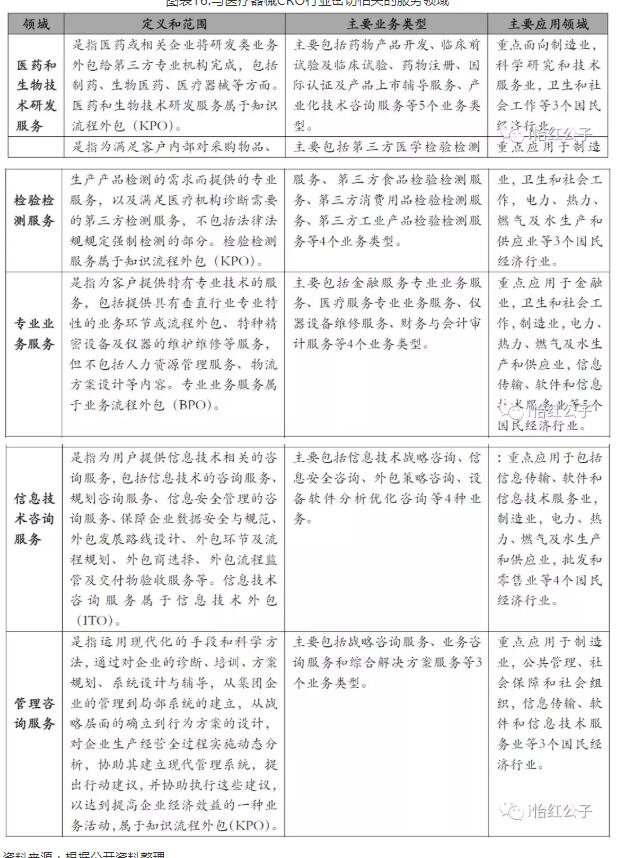
资料来源:根据公开资料整理
2017年4月28日,商务部等五部委印发了《国际服务外包产业发展“十三五”规划》,规划指出:到 2020年,我国企业承接离岸服务外包合同执行金额超过 1000 亿美元,年均增长 10%以上。事实上,我国经济发展进入新常态,向形态更高级、分工更优化、结构更合理阶段演化的趋势更加明显。供给侧结构性改革继续深入推进,将加快推动各类资源要素向现代服务业聚集,为服务外包产业发展营造更加有利的环境。同时,文件指出,在十三五期间我国国际服务外包产业发展要集中发展十二个重点领域,这其中就包括与医疗器械CRO密切相关的医药和生物技术研发服务、管理咨询服务、工程技术服务、供应链管理服务、大数据分析服务、工业设计服务等领域。
事实上,CRO也可以看做市社会劳动专业分工的延伸,当社会分工更加精细,社会就会出现专业化的团队,医疗企业撤销医学部,将部分工作外包给外部服务机构。从另外一个角度看,临床试验专业化导致成本更低,当外部交易成本低于内部交易成本时,理性的企业法人把临床试验交由外部机构负责,从而削减成本支出。
因此,通过和CRO公司的合作,生物医药和医疗器械企业集中做自己擅长的、核心的业务,将本来由企业内部完成的非核心业务,以服务外包的形式交给更专业、高效的外部供应商——高度专业化的和具有丰富临床研究经验的临床研究队伍来完成,这不仅为企业节省了时间和金钱,更是企业增强竞争力的战略选择之一。
4.2、医疗器械MAH制度试行并有望全国推广
一直以来,按照相关法律法规规定,我国医疗器械产品上市销售必须获得注册许可证(或者备案许可证)和生产许可证,按照注册管理办法的规定,只有具备生产能力的企业才有资格申请注册许可(产品注册和生产许可“捆绑”模式)并生产上市销售,委托生产只允许双方同时具备医疗器械注册证和生产许可证的企业才能申请办理,这种“捆绑”的管理模式影响力创新研发和持续提供产品质量,也限制了创新要素和社会资源的合理配置,也与国际通行的上市许可人制度不符。
2015年8月18日,国务院发布了《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)吹响了改革的号角,也是被业内公认的近年来最具改革精神的文件之一,以“44号文”的发布为契机,国家先后对《医疗器械监督管理条例》、《医疗器械生产监督管理办法》和《医疗器械经营监督管理办法》等进行了修订,以期望适应新时代的发展要求。
2017年10月8日,中共中央办公厅国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,在第二十二条文件明确指出要推动上市许可持有人制度全面实施,允许医疗器械研发机构和科研人员申请医疗器械上市许可,并对医疗器械上市许可持有人、医疗器械委托生产者以及医疗器械CRO公司之间的相关责任进行了明确规定。笔者认为,此举对于医疗器械CRO行业的发展的具有里程碑式的意义。
2017年12月7日,上海市食品药品监督管理局印发了关于实施《中国(上海)自由贸易试验区内医疗器械注册人制度试点工作实施方案》的通知(沪食药监械管〔2017〕257号),通知允许在上海自由贸易试验区内取的医疗器械注册证的医疗器械注册人委托上海市行政区域内具备相应生产条件的企业生产样品和产品,且允许注册人多点委托生产。
2018年5月24日,国务院印发了《进一步深化中国(广东)、(天津)自由贸易试验区改革开放方案》,允许广东及天津自贸区内医疗器械注册申请人能够委托广东省及天津市医疗器械生产企业生产产品,预示着此前试点的上海医疗器械注册人制度正式扩展到广东、天津两地。
2018年6月25日,司法部公布了《医疗器械监督管理条例修正案(草案送审稿)》,草案规定:“申请医疗器械上市的,应当向负责药品监督管理的部门办理备案或者经国务院药品监督管理部门批准。取得备案凭证或者医疗器械注册证的,为医疗器械上市许可持有人”;此外,草案还就并就境内、外医疗器械上市许可持有人的其他方面做了修订,正在广泛征求社会各界意见。
医疗器械上市许可持有人制度的落地试点,实现了医疗器械产品注册证和医疗器械生产许可的“解绑”,让医疗器械企业委外“样品生产+规模生产”成为可能,也预示着技术创新能力未来将成为中小型医疗器械企业的核心竞争力。一旦医疗器械上市许可持有人制度在全国范围实施,必将对整个器械CRO行业带来红利。
图表17、未来医疗器械生产模式图
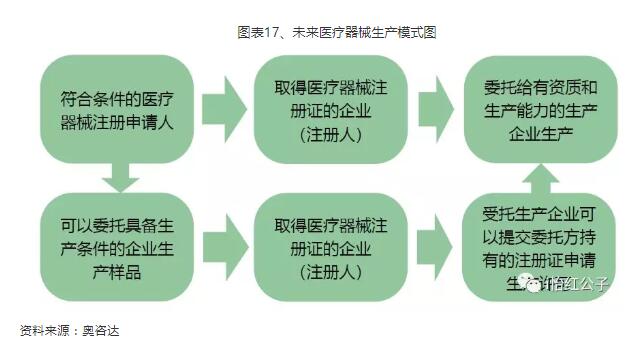
资料来源:奥咨达
4.3、器械消费占比提升
医疗器械行业是一个快速扩容的新兴市场,2017我国医疗器械市场规模达到5233亿元。随着人均可支配收入的持续增长和老龄化的日益加剧,我国医疗器械市场未来仍将呈高速增长之势。
从外部市场对看,2017年全球医疗器械消费水平占比,美国占全球医疗器械消费市场的40%,其次是欧盟33%,日本11%,中国仅占全球医疗消费市场的3%。中国的医疗器械行业发展状况,距离欧美日发达国家大概有10-20年的差距。此外,发达国家医疗器械与药品的产值比与消费比都约为1:1,而我国仅为0.20:1,即便是扣除国内药价虚高等因素,仍然有很大的上升空间,也蕴含着巨大的机遇。
总的来说,医疗器械CRO因医疗器械产业而产生发展,医疗器械市场的持续扩容势必会带动医疗器械CRO行业的向上发展。
但是,不得不说的是,在当下国内市场,对于个别企业而言,CRO公司也是医疗器械公司研发、营销费用合规“走票洗钱”的路径之一。











