医疗器械制造展喜报:国家医保局这一行动支持国产创新医疗器械
2023-02-07
2月3日,医疗器械制造展Medtec China 2023了解到国家医保局发布《关于政协十三届全国委员会第五次会议第03270号(社会管理类306号)提案答复的函》,函中对支持国产医疗器械进行相关答复。
国家医保局回复:
药监局认真贯彻落实国务院《关于改革药品医疗器械审评审批制度的意见》和中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,积极推进医疗器械审评审批制度改革工作。
2014 年发布《创新医疗器械特别审批程序(试行)》,2018年经修改完善后发布《创新医疗器械特别审查程序》,针对具有我国发明专利、技术上具有国内首创、国际领先水平,并且具有显著临床应用价值的医疗器械设置特别审批通道。相关部门按照早期介入、专人负责、全程指导的原则,在标准不降低、程序不减少的前提下,对创新医疗器械予以优先办理,并加强与申请人沟通交流。
2016 年发布《医疗器械优先审批程序》,对列入国家科技重大专项或者重点研发计划的医疗器械、诊断或治疗罕见病、恶性肿瘤、老年人特有和多发疾病、专用于儿童的医疗器械以及临床急需医疗器械予以优先审批,促进此类产品尽快上市。
《创新医疗器械特别审批程序(试行)》和《医疗器械优先审批程序》,对于鼓励医疗器械产业创新,促进临床急需的医疗器械尽快上市发挥了重要作用。符合条件的相关医疗器械可以申请按相应程序加快审批。
降本控费大环境下,政策为创新医疗器械亮起的绿灯一直未灭,无论是集采还是DRG,都无一例外绕过创新器械。
2022年10月12日,国家医保局发布《关于政协十三届全国委员会第五次会议第02866号(社会管理类263号)提案答复的函》,回应医疗器械创新产品采购问题。开展的脊柱类耗材集采中,3D打印脊柱产品由企业自主选择是否参加。
对此,国家医保局表示:考虑到3D打印产品还处于初创阶段,市场竞争不充分,并且产品特性较为复杂,有些产品具有个性化定制的特点,其成本及功效与批量生产产品难以简单直接对比。同时,对于未参加集采的3D打印产品,将在后续工作中对挂网价进行规范。
同时进一步明确,对类似3D打印骨科耗材等创新产品,考虑技术特点、生产成本、使用情况、临床功效等特性,采取“一品一策”的方式,确定合适的采购规则,完善以市场为主导的价格形成机制,促进医疗器械行业高质量发展,以合理的价格为人民群众提供更多的创新产品。
去年9月,国家医保局《对十三届全国人大五次会议第4955号建议的答复》。其中明确指出,由于创新医疗器械临床使用尚未成熟、使用量暂时难以预估,尚难以实施带量方式。在集中带量采购过程中,国家医保局会根据临床使用特征、市场竞争格局和中选企业数量等因素合理确定带量比例,在集中带量采购之外留出一定市场为创新产品开拓市场提供空间。
集采“豁免权”,给创新医疗器械发展留足了安全感。不仅集采,DRG同样绕过了创新器械。
去年7月,北京市医保局发布《关于印发CHS-DRG付费新药新技术除外支付管理办法的通知(试行)》。根据规定,符合条件的新药、新技术将在北京市获得CHS-DRG付费“豁免权”。
根据通知,“三年内(指含申报年度及之前的两个自然年度,下同)经药监部门批准上市的新通用名药品/医疗器械;三年内因增加功能主治或适应症发生重大变化的药品;三年内新纳入国家医保药品目录的药品;三年内由于价格调整新增的可另行收费的医疗器械”,可以申报CHS-DRG付费豁免。
三年的窗口期让创新医疗器械可以享有较为充足的自然发展周期。
不仅北京,国家医保局在《对十三届全国人大五次会议第8013号建议的答复》中也提到,正研究完善相关政策,指导各地及时将符合条件的创新医用耗材按程序纳入医保支付范围。同时,在推进医保支付方式改革,确定按疾病诊断相关分组(CHS-DRG)、按病种分值付费(DIP)支付标准等环节,对创新医用耗材等按相关规定和程序予以支持。
业内人士谈到,国家政策正在为创新医疗器械提供非常难得的发展窗口期,无论是监管、政策扶持以及医院考核指标等,都给国产创新医疗器械留出了发展空间,巨大的发展潜力不断吸引资本市场关注。
国产医疗器械设备亟需创新,设计工程师寻找灵感来医疗器械制造展Medtec China 2023,呈现100多场高品质演讲,论坛覆盖医用材料、高端有源医疗设备、塑模成型、精密加工、3D打印、包装与灭菌、牙科、自动化等多项主题论坛。
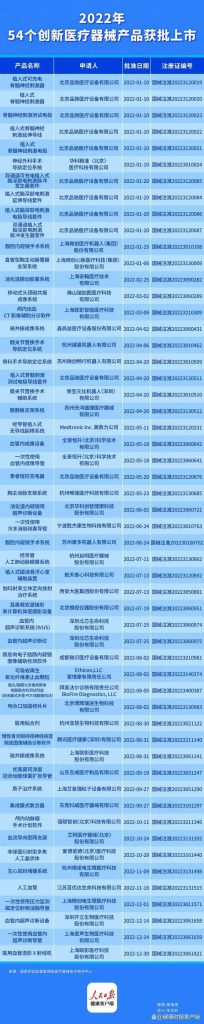
随着医疗器械审评审批制度改革纵深推进,国产创新器械步伐继续加快。据人民日报健康客尺户端梳理发现,2022年国家药监局公示了54个三类创新器械获批上市,相目较2021年的35个有大幅提升。
文章来源:赛柏蓝器械












