上海医疗器械博览会学术分享:应用纳米材料类医疗器械产品现状探讨
2024-03-25
上海医疗器械博览会Medtec China 掌握到目前应用纳米材料类医疗器械产品的现状,探讨提升应用纳米材料类医疗器械产品质量的策略。
方法:通过查询国内外文献及国家药品监督管理局网站,结合应用纳米材料类医疗器械产品企业的问卷调研情况,对应用纳米材料类医疗器械产品现状进行分析。结果:目前应用纳米材料类医疗器械产品上市产品少、大部分产品延续注册前需进一步完成许多研究工作等。结论:建议对已上市产品严格追溯控制上市产品质量,加强对未上市产品的安全有效性研究,加强对企业人员、审评人员和检查人员专业知识培训,促进应用纳米材料类医疗器械的高质量发展。
关 键 词:应用纳米材料 医疗器械 质量管理 培训
纳米材料已在很多工业领域里得到广泛应用,如在体外诊断试剂、植入物和组织工程产品/ 新型药物投送系统、中均具有广阔的应用前景。应用纳米类医疗器械产品是一类含有或组合有纳米材料,并以其纳米材料的特殊性能发挥预期生物效应的医疗器械产品[1,2]。目前,已有多种形式的应用纳米材料的医疗器械,包括利用纳米技术设计制备的结构型、固化型、游离型、以及未含纳米材料的医疗器械,它们都可以通过改变其特性来提高生物学活性,并且可以有效地预防和治疗感染。然而,由于某些原因,这些医疗器械在使用/植入时可能会出现纳米颗粒的产生[3]。
1.1 国内监管进展
2004 年,我国原国家食品药品监督管理局《关于纳米银妇用抗菌器等产品分类界定的通知》首次出台,将其划归Ⅱ类医用器具,并在9月1 日开始实施,截止2006 年,已经有10 个以纳米级金属材料制作的抗菌器品种被授予Ⅱ类医用器具的认可。尽管纳米级复合材料具备许多优异的性能,然而,随着2006 年4 月11 日《有关纳米生物材料类医药机械商品类别政策修改的通告》的出台,这些药物的使用范围从Ⅱ类扩展到Ⅲ类,因此,对于那些拥有纳米生物材料的医药产品,必须加以严格的监管,以确保其不会对健康造成不可挽回的损害,从而降低其对环境和公众健康的危害。Ⅱ级注册证的使用范围是:生产、销售、维护。如果Ⅱ级注册证已经过时,必须进行Ⅲ级注册,并遵守相应的法律法规。此前已受理但还没有审批的含有纳米生物材料类的医疗器械,转国家食品药品监督管理局按Ⅲ类医疗器械审批注册。2012年8 月22 日,国家食品药品监督管理局办公室发出食药监办械[2012]105 号通知,《关于纳米银类产品重新注册有关事宜的通知》,为把握和掌控纳米材料类产品的安全性问题,国家食品药品监督管理局医疗器械技术审评中心组织专家论证,明确了含有纳米生物材料类的医疗器械产品注册审评要求,同时向相关企业发出补充资料通知,分别要求补充相关研究资料和验证资料,如细胞毒性和基因毒性的评价、纳米材料的表征、生物相容性评价、质量控制等方面。对于纳米银类产品,如果已经按照第三类医疗器械申请重新注册,企业应当在2014 年8 月31 日前按照补充资料通知的要求一次性补齐。届时不能补充资料的,或者补充的资料仍不能符合安全性有效性要求的,不予注册。由国家纳米科学中心牵头,国家药品监督管理局医疗器械技术审评中心和中国食品药品检定研究院于2020 年联合组建的国家药监局纳米技术产品研究与评价重点实验室组建。2021 年,国家药监局在第二批监管科学行动计划研究项目中,包含了纳米医疗器械监管科学研究项目。在2022 年8 月23 日,国家药品监督管理局公开发表了针对使用纳米技术的医疗设备的安全与有效性评估的指南,其中包含了对设备的分类、风险与收益的评估、以及对设备的安全性进行评估的步骤。此外,还建议使用这种技术设备进行有效性检查,并采取多种检查手段,如台架检查、体内检查、电脑仿真、动物实验以及临床试验等。这一部分提供了一个全面的评估方法,来衡量使用纳米材料制造的医疗设备的效果。这个方法涵盖了理化特性、生命周期、动态试验、外源替代测试/ 电子模型仿真和临床试验。
上海医疗器械博览会Medtec China 2号馆助力医用材料及核心部件全新升级,展示范围纵横拓展,从医用材料(高分子/复合材料)及其部件、粘结剂,粘结产品到金属材料&金属部件,陶瓷及相关加工工艺、IVD试剂,流体控制,过滤及静脉注射,实验室、管件和挤压加工产品等,部分确认参展企业:加拿大HnG、迈图、路博润、汉高乐泰、Nusil、田中贵、韦恩堡、3M、美国ZEUS、德菲特、浙江脉通智造、摩方新材料,优德精密等。点击立刻加入Medtec China 2024。
1.2 国外监管进展
2000 年,国家纳米技术倡议的创立,使美国政府机构在纳米技术方面的研究,食品药品监督管理局(Food and Drug Administration,FDA)启动了一项旨在增进其纳米技术科学知识的项目,以确保FDA的科学家准备好应对纳米技术产品可能带来的监管挑战,于2006 年成立了纳米技术工作组,负责识别监管方法,鼓励持续开发采用纳米技术的创新、安全、有效的FDA监管产品。识别并推荐解决知识或政策差距的方法,使FDA能够评估创新产品并保护公众健康。同时也帮助评估FDA的各个监管机构应对纳米技术的现状。2010年,美国FDA颁布的《行业最终指南:考虑FDA监督商品能否涵盖纳米技术的应用》(Considering Whether an FDA-Regulated Product Involves the Application of Nanotechnology)[4],为美国FDA提供了5 份有关商品纳米科技应用领域的最终指南,并且这些指南也一直被持续更新,以确保美国FDA能够有效地监督商品纳米技术的应用。这份指南提供了一个完整的FDA纳米技术商品监督机制,旨在保障所使用的纳米材料和相关产品的安全和有效性。它建议,只要符合两个条件的物品,即它们的尺寸和形状符合100nm的标准,并且它们的设计应当反映它们的尺寸和形状,从而使它们符合FDA的标准。2018年,美国FDA公开了一份关于纳米材料的遗传毒性评价指南,该指南涵盖了各种形式的纳米粒子,无论是其物理、化学特征还是生物活动,其粒径均<1μm(1000nm)[5]。
2006 年,欧洲标准化委员会建立了一个全球性的机构,以确保Ⅲ类医疗器械的有效性和安全性,该机构负责研究和评估各种纳米级颗粒、成分或部件,以确保它们不会被释放到患者的器官、组织、细胞或分子中。欧盟于2010 年启动了3个针对纳米材料的REACH 执行项目,旨在分析物质和混合物分类、标签和包装监管纳米材料的信息要求、化学品安全评估、纳米物质鉴定等。2011 年发布了《欧洲委员会关于纳米材料的定义》(European Commission Definition of a Nanomaterial)2015 年发布《医疗器械中应用的纳米材料潜在健康影响的确定》(Guidance on the Determination of Potential Health Effects of Nanomaterials Used in Medical Devices),为了更好地保护患者的安全,全球监管部门颁布了第一个关于使用纳米技术的指南,以便为生产者提供有关该技术的参考,以便他们能够更好地评估其可能带来的健康影响[6,7]。2017 年3 月份,欧盟委员会正式发布了“欧盟纳米技术政策框架”,其中包括了纳米医疗器械的监管要求和安全评估要求。该框架旨在为纳米技术的立法与监管提供全面的指导。
2.1 国外产品上市情况
目前,美国与欧盟已经有许多纳米类医疗器械上市或正在接受FDA的评估。其中,具有代表性的包括:纳米颗粒药物输送系统,该技术是将药物包裹在纳米尺度的粒子中,达到精准治疗的效果。已经有许多纳米颗粒药物输送系统被FDA批准上市,例如Docetaxel (Taxotere)、Doxil (doxorubicin HCl liposome injection)等。纳米药物成像技术,该技术是利用纳米材料的磁性、光学等特性实现对患者体内病变区域的成像。目前,一些针对肿瘤病变的纳米药物成像技术已经在临床应用阶段,例如C nanoshells、Quantum dots等。纳米探针技术,该技术是利用纳米粒子的光学、磁性等特性对特定疾病标志物进行检测。目前,上海医疗器械博览会Medtec China 了解到许多纳米探针技术正在研究开发中,例如利用纳米金粒子技术对人类免疫缺陷病毒进行检测。美国的阿比韦公司推出的“Titanoceram”纳米植入物已经获得FDA批准用于临床试验,该产品主要应用于人工髋关节等领域。法国的雅培公司研究开发出的纳米抗菌技术,则可广泛应用于医疗设备、医用材料等领域[8-10]。尽管美国与欧盟纳米类医疗器械市场在不断增长,但是由于纳米技术的应用仍面临一些风险和挑战,如生物相容性问题、长期安全性问题等,FDA与欧盟在批准这些纳米类医疗器械上市时十分谨慎[11]。
2.2 国内产品上市情况
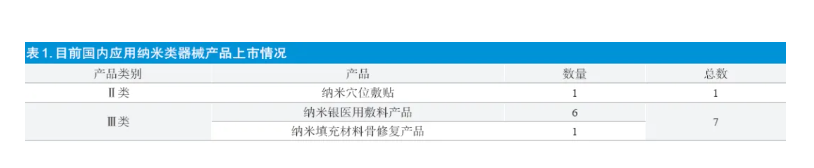
2004 年,我国的纳米材料医疗器械首次推出,以纳米银为基础的抗菌类产品占据了大部分的份额;而到了2006年,这一类型的药物的销售额达到了惊人的水平,达到了56%,此外,还推出了一种新型的医学建筑材料,即由氢化磷灰石/ 聚酰胺66 组成的骨充填材料。自2007 年以来,已经有50 种已经获得Ⅱ类医疗器械认可的纳米材料产品正在寻求再次获得Ⅲ类认可。然而,目前仅剩下一种已经通过认可的纳米材料,即由氢化磷灰石/ 聚酰胺66 组成的复合型骨充填材料,尚无法再次获得认可。根据“纳米/Nano”的相关信息,可以看到,目前国内上市的纳米药物包括:使用银离子制成的护肤膏、使用银离子填补的牙膏、使用银离子、量子点、磁性微粒、磁性胶粒等的体外实验药物。目前,国内在开发一种新型的纳米防护服,它能够满足GB19082-2009《医用一次性使用防护服技术要求》的要求,旨在帮助医疗从业者更好地与存在传播风险的病毒、细菌、病毒残留物和污染源保持距离,从而起到保护和隔绝的效果。这款产品的独特之处体现在它的外层采用了高科技的纳米材料层,而内层则采用了高科技的杀菌层,这些层分别由棉布、纯棉府绸、二氧化肽层以及银离子层组成。当它穿着这款产品的时候,它的外层可以有效地阻挡飞沬的溅射、黏附,以及渗透到内层,即便只有极少量的细菌侵入,它们仍然可以被杀菌层所吸收,最终由富含银的抗菌离子将细菌消灭。通过查询药监局网站,了解应用纳米类医疗器械产品注册情况,并选取了较有代表性的16 家纳米类医疗器械企业进行问卷调研。收到反馈15 份(2 家企业定为非纳米产品);1 家企业未反馈(企业破产);13 家企业有效问卷。
调研的9 家纳米类无源医疗器械生产企业中,涉及产品14 个,其中已经上市产品8 个,退市产品1 个,正在申报或正在研发中的产品5 个。见图1。
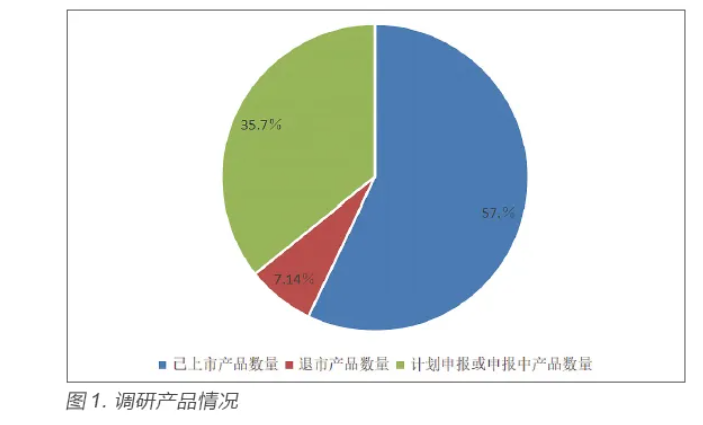
当前应用纳米材料类医疗器械产品上市不多,原因主要集中在以下几个方面:①由于当前的原材料市场发展水平较低,加之对于工艺技术的缺乏,以及对于纳米材料的安全有效性的缺乏,使得这些产品一旦投放使用,就会存在较大的风险;而且,由于纳米材料具备独特的结构,它们的理化性质、药理学、毒理学、代谢动力学都会发生变异,研发较为复杂。②目前纳米材料医疗器械产品整体还处在探索阶段,申报周期相对较长,且得到批准的产品较少;国内纳米材料基础研究还有待深入,在医疗器械应用研究相对薄弱,临床实用化转化力度不足,且纳米类医疗器械产品注册审批可能周期过长,存在投资收益比不匹配。③该类产品的技术标准不成熟,法规文件相对不完善;应用纳米材料类医疗器械大部分是三类产品,产品风险相对较高;因其生物安全性问题等,国家对该类产品的监管更加严格。
①对已上市产品,严格追溯控制,掌握终端去向,加严不良事件监测,将上市后数据与上市前审批互动,重视不良事件的收集、分析,如有必要企业可以对生物安全性进一步研究。加强对应用纳米材料类产品广告宣传的监管,防止企业炒作概念,炒作疗效。②对于未上市产品,在安全性尚未明确的情况下,加强对该类产品申报的审评审批。注重产品安全有效性研究,如在体内代谢及最终去向的基础研究、材料在产品宣称的预期用途中发挥的功效及相关验证;纳米材料对人体的长期安全性研究、纳米材料释放风险、生物安全评价研究等。③进一步制定和完善应用纳米材料类医疗器械的相关标准,定期对企业、审评检查人员等开展相关培训,提升企业研发能力和风险防控能力、提高政府部门的审评能力和监管水平。
文章来源:











