2024医疗器械展会Medtec解读用于医疗应用的 ePTFE 官能化
2024-09-13
一、简介
膨体聚四氟乙烯 (ePTFE) 是一种通过拉伸大块材料 PTFE 获得的聚合物,可实现多项有益特性。PTFE 是最常见的含氟聚合物,因其润滑性而迅速得到认可。然后,它在大众市场上广泛用作煎锅上的防粘(特氟龙)涂层。然而,已发现 PTFE 的许多其他特性,导致其在众多工业领域中用于各种应用。在本文中,讨论将仅限于生物医学领域,因为 PTFE 已被证明具有生物相容性。如今,在人体中可以找到由 PTFE 制成的可植入部件,适用于多种情况,包括血管成形术导管、长期稳定的眼眶植入物、声带缺陷、骨科关节植入物、面部整形手术或恢复心包完整性的膜。除此之外,用于人体生物医学分析的设备也由聚四氟乙烯制成。
PTFE 材料以其块状、薄膜、片材或膨胀形式存在。后者专用于具有 PTFE 基本特性但又丰富了医疗应用的几个有趣特性的生物材料。
此外,2024医疗器械展会Medtec了解到,材料的化学稳定性和疏水性应允许植入物和移植物在植入 ePTFE 时不会粘附在细菌或蛋白质上,但也会粘附在细胞上。然而,由于细菌粘附引起的院内疾病经常发生,并且血小板等蛋白质仍然是血管移植物的问题,因为它们会导致血栓形成。用于组织工程或植入组织整合的细胞的非粘附性也是一个需要解决的问题。
聚合物的表面官能化,尤其是 ePTFE 的表面官能化是生物医学应用的主要关注点。以前的评论主要集中在改进 ePTFE 用于某些医疗应用,解决最具挑战性的领域或有前途的技术。其他人通常对生物材料的修饰特别感兴趣,对方法或医学领域特别感兴趣。在本文中,我们概述了用于 ePTFE 官能化的多学科技术,所有医学领域都被考虑在内。
就 ePTFE 的改进特性而言,研究涉及三个领域:抗菌、抗狭窄以及组织或细胞粘附特性。我们的评论依赖于文献中的文章,并基于“ePTFE 抗菌官能化”、“ePTFE 血管移植官能化”、“ePTFE 组织粘附官能化”和“ePTFE 细胞粘附官能化”。本次审查选择了调查时最相关和/或最近的文章。本文详细介绍了一些感兴趣的文章的结果,并通过详尽的表格(表 1)更简洁地介绍了最先进的方法及其应用领域(表 2)。
 表 1:细菌粘附试验(材料表面上表皮葡萄球菌的菌落形成单位)。
表 1:细菌粘附试验(材料表面上表皮葡萄球菌的菌落形成单位)。
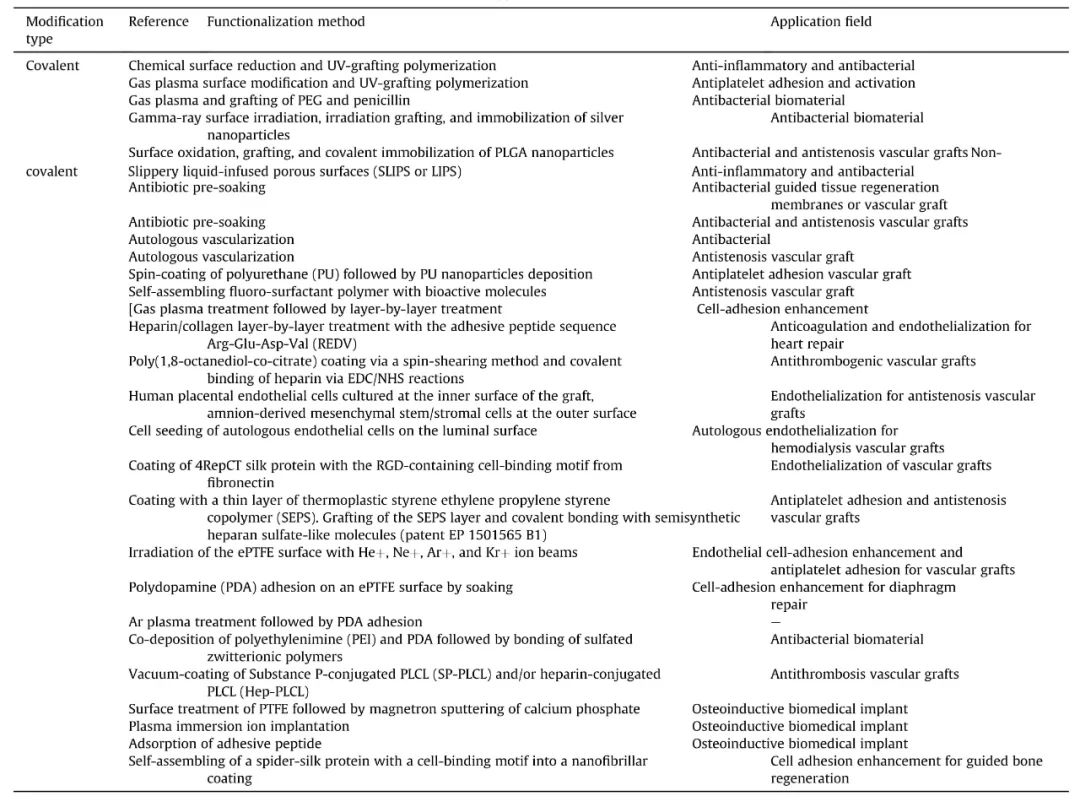
表 2:引用文章的参考列表,详细介绍了官能化方法和应用领域。
二、 ePTFE介绍
2.1. 历史
PTFE 于 1938 年由 Roy Plunkett 在杜邦公司发现,直到 1946 年才为第二次世界大战秘密订购。1950 年,杜邦是 PTFE 的大型生产商和供应商,但提供的制成品很少。威尔伯特·L·戈尔 (Wilbert L. Gore) 是杜邦公司的一名员工,但他对 PTFE 的应用有着更出色的想法。1958年,他决定秉承创新创业精神,离开杜邦公司,开创自己的事业。他通过开发和销售 PTFE 绝缘电线电缆开始了他的活动,并获得了他的第一项专利。这些产品主要用于国防和新兴 IT 行业。威尔伯特·戈尔 (Wilbert Gore) 的创新意图并没有停止,因为他打算开发一种新形式的 PTFE,这种材料在散装材料中包含更多空气,重量更轻,因此生产成本更低。威尔伯特·戈尔 (Wilbert Gore) 的儿子鲍勃·戈尔 (Bob Gore) 尝试了多种方法,通过拉伸将块状 PTFE 变成泡沫,但材料在热处理后在缓慢的拉伸率 (<50 毫米/分钟) 下继续断裂。高温处理后的高应变率测试突然使聚合物伸长了1000%,而缓慢的拉伸使其拉伸了10-20%。W.L. 公司 Gore & Associates 于 1976 年以 Gore-Tex 的名称为这种新型 PTFE(ePTFE)申请了专利。而 John W.Cropper 于 1966 年首次发现了一种生产膨体聚四氟乙烯 (ePTFE) 的工艺,1970 年代一场响亮的法律战(称为戈尔诉加洛克案判决)取消了对该发明的任何权利要求。由于没有申请公共专利,这种材料的新形式无法得到法律认可。
PTFE是一种仅由碳原子和氟原子组成的聚合物,形成-(CF2)n-螺旋链,其中C-C和C-F键非常牢固。由于其低表面自由能(20℃时约为 19 mJ/m²),这种化学组成和结构赋予了 PTFE 显着的特性,例如耐化学性、热稳定性和疏水性。后一个值解释了为什么材料的自由表面能越低,就越难用表面能较高的溶剂(例如水)润湿它。对 PTFE 表面进行一些物理处理会增加表面的自由能值。
两种主要工艺用于获得 ePTFE。第一个从纯 PTFE 细粉开始。添加润滑剂直至获得糊状物,然后将其挤出成片状。后者在高应变率下被加热和膨胀以生产微孔板。该结构在无定形锁定步骤中稳定,不会像大多数聚合物那样发生断裂。以极高的速率变形会增加所得膨体聚四氟乙烯的拉伸强度。由于润滑剂的沸点较低,因此在工艺结束时将其去除,从而产生 100% ePTFE。
第二种从制药行业的角度来看比前一种影响更小,因为产品纯度较低。此过程中的一些步骤涉及将 PTFE 粉末分别与可燃或易散材料(例如纸纤维或碳酸盐)混合。然后,它们通过加热被去除,但污染物的痕迹使它们不适合用于生物医学。主要应用包括用于微滤的微孔膨体聚四氟乙烯膜。
2024医疗器械展会Medtec现场将举办同期技术论坛H:第五届医疗器械高端数字化制造技术论坛,工业数字化设备不仅可以提高生产效率,还可以提高产品质量和生产安全性。未来,数字化技术将成为医疗器械生产行业的重要组成部分,为医疗器械生产带来更多的便利和效益。现在报名参观即可免费参会!
PTFE用于多种医疗用途,针对不同的器官和系统(心血管系统、泌尿系统、神经系统等)。发生在医院的院内感染是各种严重疾病的病因,主要由细菌引起,其次是微真菌。实际上,它们已被公认为发病率和死亡率的主要来源。在这种情况下,由 ePTFE 假体引起的植入后感染非常严重,可能危及生命,其中三分之一的血管移植物感染是致命的。事实上,ePTFE 的微孔大到足以让细菌生长,但又太小以至于免疫细胞无法接触到孔中的微生物。与生物工程脱细胞血管相比,ePTFE 血管移植物在接种两周后显示金黄色葡萄球菌和大肠杆菌的定植率是设计血管的五倍。
此外,随着抗生素的使用,出现了抗菌素耐药性 (AMR)。氨基糖苷类、青霉素、头孢菌素和碳青霉烯类是通常选择用于临床治疗感染的抗生素的例子。随着 AMR 在全球范围内的增加,对人口健康的威胁相当大。主要的耐药细菌是金黄色葡萄球菌、铜绿假单胞菌、肺炎克雷伯菌、大肠杆菌和鲍曼不动杆菌。
尽管 ePTFE 和含氟聚合物通常具有高度疏水性,但它们的表面仍会发生生物反应。例如,血清白蛋白和纤维蛋白等血液成分的粘附可导致补体激活、血小板粘附和凝血途径激活。这种反应会导致移植物闭塞。移植物和宿主血管之间顺应性的差异也参与移植物闭塞过程,因为它有助于激活新内膜增生。例如,ePTFE 对于大直径的动脉移植物具有 40-50% 的令人满意的最大通畅率,而较小的移植物仅达到 20-25% 的通畅率,而相同直径的静脉移植物具有良好的通畅率。
ePTFE 的惰性可防止细胞粘附到假体及其微孔结构上,以促进细胞渗透和组织向内生长。在先天性膈疝的治疗中,膨体聚四氟乙烯膜被用来代替膈肌。聚合物较差的粘附性适用于腹部,但不适用于需要特定粘附和组织整合的胸部。ePTFE 植入物的骨结合特性也是一个被研究作为组织间隙填充物的线索,例如,在 Refs.Tissue 中还需要细胞粘附到 ePTFE 上,从而使支架能够整合到接触的组织中,例如前交叉韧带细胞。
三、ePTFE 的表面改性和官能化以解决医疗问题
2024医疗器械展会Medtec认为,在过去的几十年中,PTFE 的表面官能化已通过多种技术得到发展。对于 ePTFE,所选择的策略是共价或非共价官能化。由于 ePTFE 的初始惰性,共价官能化通常涉及通过与高活性物质的紧密键合对 ePTFE 进行表面改性,而接触官能化则使用孔隙率等结构特性或疏水性等物理特性。
3.1. 共价键合
在进行ePTFE的接枝之前,需要对碳碳氟键进行永久性修饰。尽管聚四氟乙烯具有许多显着的性能,但要在表面引入官能团却非常困难。有时为了粘合和进一步官能化,必须牺牲其润滑性。例如,PTFE 可以在几分钟内用由溶解在 2-甲氧基乙基醚中的萘钠络合物组成的商业蚀刻剂 (FluoroEtch) 进行化学蚀刻。异丙醇用于阻止攻击。为了继续使用碱金属,也可以使用 BillupseBirch 还原反应对 PTFE 表面进行化学改性。在这种情况下,聚多巴胺的聚多巴胺官能化已在几项使用涂层 ePTFE 用于医疗应用的研究中实现。官能化的机制如图 1 所示。
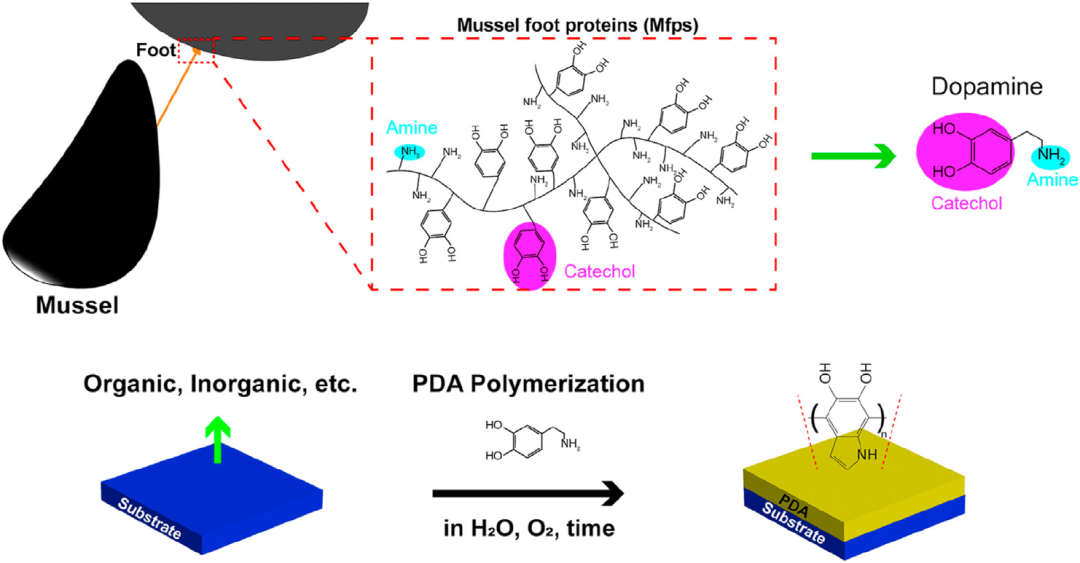 图 1. 多巴胺受贻贝启发的化学示意图,用作合成和沉积保形聚多巴胺 (PDA) 薄膜的前体材料。
图 1. 多巴胺受贻贝启发的化学示意图,用作合成和沉积保形聚多巴胺 (PDA) 薄膜的前体材料。
根据建议的工艺,用于化学还原材料表面的另一种可能性是对表面进行化学处理,如图 2 所示,其中 C-F 键部分还原为 C-H。这已被应用于改善抗菌和抗炎特性,这对 ePTFE 植入物可能涉及的问题很有意义。建议的工艺是如图 2 所示的表面化学处理,其中 C-F 键部分还原为 C-H 键。化学路线是在紫外光下用DMF中的双苯酮/NaH处理ePTFE。然后,2-甲基丙烯酰氧乙基磷酰胆碱 (PMPC) 在紫外光下接枝并聚合到还原表面。已对改性表面材料进行了体外和体内测试,以评估细菌粘附和炎症反应。在体外测试了牛血浆纤维蛋白原的蛋白质粘附、成纤维细胞 (NIH3T3) 的粘附和活化以及金黄色葡萄球菌的细菌粘附,发现与未修饰的 ePTFE 相比,PMPC 接枝的 ePTFE 显着降低。定量荧光强度结果表明,与未修饰的相比,官能化板的金黄色葡萄球菌的粘附和生长减少了 60%。在 ePTFE 上使用相同的分子与 Ar 等离子体处理相结合,以获得血小板抗粘附特性。
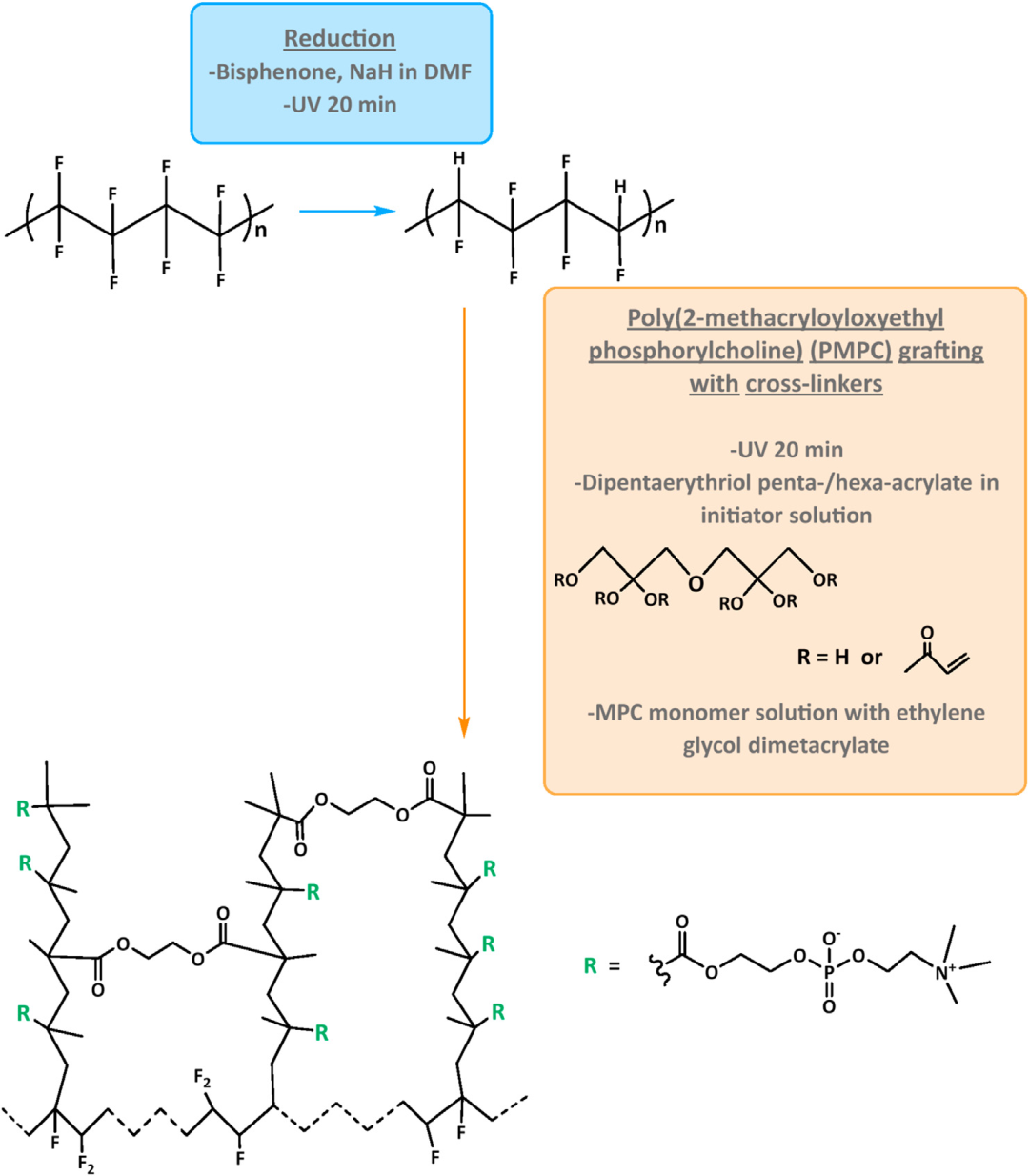
图 2. 从 ePTFE 表面活化到接枝的化学路线。
事实上,另一种改性 PTFE 或 ePTFE 表面的方法来自于在材料表面形成自由基,使用气体等离子体,或使用引发剂分子的伽马射线技术。一种众所周知的抗生素青霉素 (PEN) 已被用作使用该技术的抗菌涂层,将 Ar 等离子体与马来酸酐 (MA) 耦合。一旦 MA 接枝到聚合物表面,分子就会水解并附着在聚乙二醇 (PEG) 分子上,聚乙二醇 (PEG) 分子又会与青霉素发生反应(图 4)。ePTFE 表面在这个物理化学过程中变得抗菌。似乎金黄色葡萄球菌培养物的体外实验表明,与 ePTFE、MA-ePTFE、PEG-MA-ePTFE 或 PEN-ePTFE 相比,PEN-PEG-MA-ePTFE 的官能化在消除细菌方面是有效的(图 3).然而,该表面并不能预测地消除革兰氏阴性菌,例如铜绿假单胞菌。可以提出通过酯键连接到 PEG 的 PEN 释放问题。PEN-PEG-MA-ePTFE 在 37 ℃ 下暴露于 PBS 缓冲溶液中,随着时间的推移 C=O 酯键的 ATR-FTIR 分析显示信号强度降低,24 小时后降低了 30%, 相当于 PEN 初始体积的 32%。这项有趣的研究没有涉及水解动力学对生物体的影响,因为除了体外没有进行其他研究。
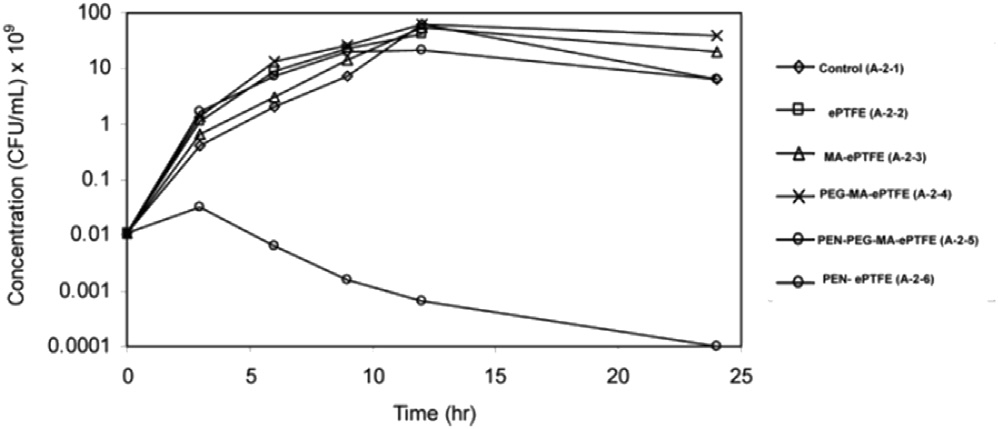
图 3. 金黄色葡萄球菌的浓度作为实验序列时间的函数绘制:对照、ePTFE、MA-ePTFE、PEG-MA-ePTFE、PEN-PEG-MA-ePTFE 和 PEN-ePTFE。
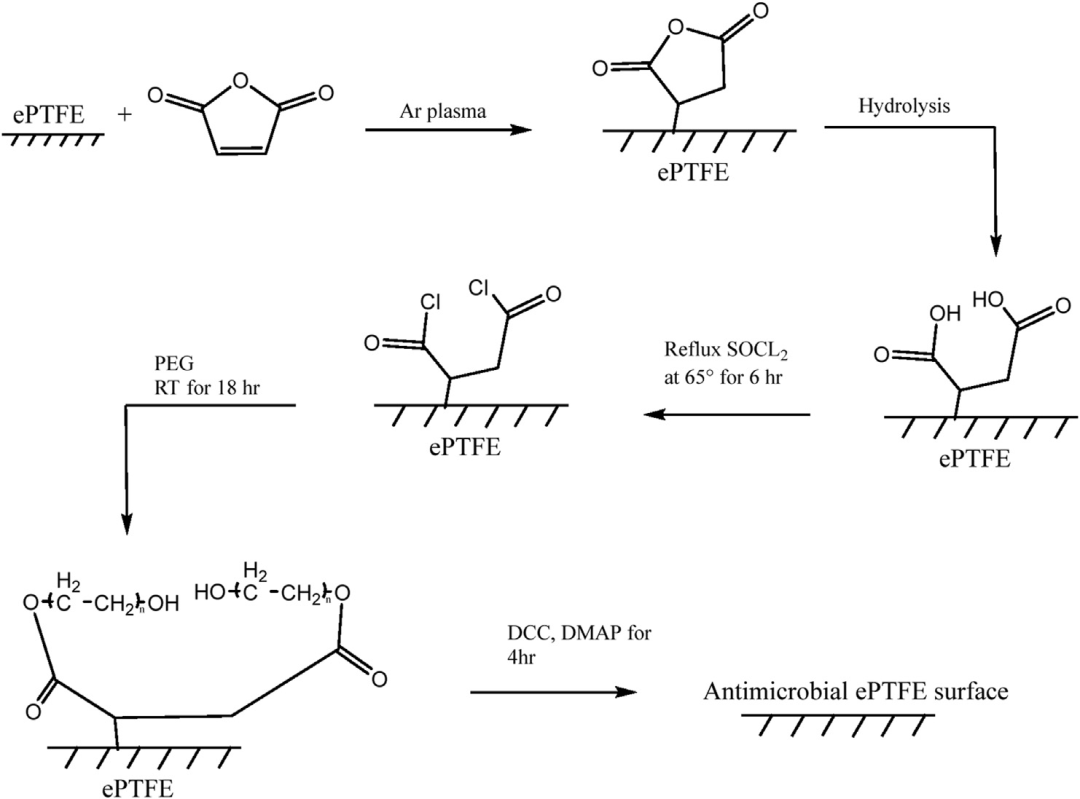
图 4. 等离子体诱导青霉素接枝的化学路线。
Ar 等离子体诱导低百分比的接枝,这归因于由于咪唑环的形成引起的空间位阻。伽马辐射是一种具有更高接枝率的技术,因为自由基直接在表面上形成。最近已经使用这种技术开发了 PTFE 薄膜的官能化。该过程包括伽马辐射,然后是甲基丙烯酸甲酯 (MMA) 接枝。然后,在存在 NVI 和甲苯溶液的情况下,通过辐照接枝材料,将 NVinylimidazole (NVI) 接枝到 MMA-PTFE 上。执行这些先前的步骤是为了在生物体的流体动力学生理条件下充分保留银纳米粒子。使用 AgNO3 水溶液暴露于接枝膜以将银固定在先前接枝的分子上。一项抗菌谱研究比较了官能化材料 MMA-ePTFE、NVIMMA-ePTFE 和 Ag/NVI-MMA-ePTFE 周围大肠杆菌或金黄色葡萄球菌存在时的抑菌圈。后者呈现出一个独特的抑制区。还通过抗菌谱评估了NVI接枝量,结果表明,表面接枝NVI量最大(15%)的NVI最有效,抑菌圈最大。TSC 介质中吸光度的定量测量证实,与 NVI 连接的银量最大的样品是最有效的。
3.2. 非共价键合
ePTFE 的非共价键合是另一种提高其抗菌性能的方法。氟化液体用于通过润滑液体薄膜的物理吸附来饱和 ePTFE 的孔隙,从而产生光滑的液体注入多孔表面(SLIPS 和 LIPS)。因此,通过这种技术创建的 SLIPS 允许 ePTFE 填充其孔隙,不再让细菌渗透并使材料更加疏水。经 SLIPS 修改获得的特性被证明可有效抵抗金黄色葡萄球菌的粘附和定植。实验在体内进行,生物材料受到金黄色葡萄球菌的污染。似乎在接种三天后,一些 SLIPS-ePTFE 底物根本没有定植,ePTFE 的大鼠感染率为 92.3%,全氟聚醚为 33.3%,全氟全氢菲和全氟萘烷为 0%。
最常见的抗菌官能化方法是将其浸泡在抗生素溶液中。四环素、阿莫西林、利福平、万古霉素或米诺环素是用于官能化的抗生素的例子。这些直接浸渍已被用于防止由 ePTFE 或人工血管移植引导的组织再生膜的细菌渗透和定植。然而,可能会提出抗生素不受控释放和过量使用对细胞活力的问题。可以重新评估植入物预防性预浸泡的好处,因为高剂量利福平的体外试验会对血管细胞产生细胞毒性。此外,抗生素耐药性与抗生素的使用密切相关。据估计,AMR 每年在美国导致至少 23,000 人死亡,在欧洲每年导致 25,000 人死亡。因此,对于全球不断增加的 AMR,应谨慎使用此解决方案。如果存在移植物感染和移植物更换的风险,则改用预先浸泡过的移植物。
为了减少细菌粘附并促进 ePTFE 移植物的生物相容性,开发了一种称为自体血管形成的方法。已经指出,材料表面上的薄壁组织或血管网络允许移植物存活。这种方法的想法是让组织在 ePTFE 的孔隙中生长,从而避免细菌渗入,因为发现具有生物活性的内皮细胞表面的细菌存活是有限的。研究已经评估了其在动物模型植入部位对抗细菌存活和慢性炎症的效率。在这里,我们提出了一项研究,首先将 ePTFE 材料植入 30 只大鼠的富含血液的皮下组织中,持续 4 周、8 周和 12 周。然后通过注射表皮葡萄球菌将生物复合材料植入目标位置。对照组在没有预先植入的情况下接受 ePTFE。细菌粘附表明,与未改性的 ePTFE 相比,使用 AV-ePTFE 后材料表面的细菌数量大约减少了两倍(表 1)。它也会随着时间的推移而减少。即使这项研究看起来有效,也可能会提出额外干预部位的手术并发症的问题。
如前所述,ePTFE 移植物的血栓形成和再狭窄是血管外科手术后遇到的主要问题。为此,一项研究成功地通过旋涂聚氨酯 (PU) 溶液并通过离心回收载有分散 PU 纳米粒子的溶液来实现 ePTFE 的官能化。这种涂层可防止血小板粘附,这是对 ePTFE 或 PU 涂层 ePTFE 的一个很好的改进。与纯 PU 相比,PU/PU-NP ePTFE 的血浆再钙化时间更长,这意味着官能化提高了移植物的血液相容性。
用于 ePTFE 涂层的另一种方法是自组装包含生物活性分子的氟表面活性剂聚合物 (FSP)。这些组分、七麦芽糖 (M7-FSP)、细胞粘附 RGD 肽 (RGD-FSP) 或内皮细胞选择性 CRRETAWAC 肽 (cRRE-FSP) 具有预期可防止 ePTFE 移植物血栓形成的特性。RGD-FPS 和 cRRE-FPS 允许在被浸渍后在肺动脉单层中形成内皮细胞。一个月后,50% 到 66% 的改良移植物仍保持专利状态。
诸如等离子体之类的激进“启动”允许进一步修改以实现逐层 (LbL) 组装到 PTFE。LbL 技术主要设计用于医疗应用,以改善细胞粘附。例如,我们在这里介绍一种使用肝素和胶原蛋白多层膜来改善 ePTFE 移植物的再内皮化和抗凝的方法。LbL 处理后还添加了内皮细胞 (EC) 粘附肽序列 Arg-Glu-AspVal(REDV),以促进细胞粘附在表面上。体外血浆再钙化时间法显示 REDV-LBL-ePTFE 的血浆凝固时间比纯的更长。在共培养 72 小时后,REDV 涂层和改性的 ePTFE 表现出 95% 的表面被静脉内皮细胞定植,而单独的 ePTFE 表现出的贴壁细胞少八倍,而 LBL-ePTFE 则四倍。不同版本的 ePTFE 上附着的细胞数量的定量结果如图 5 所示。
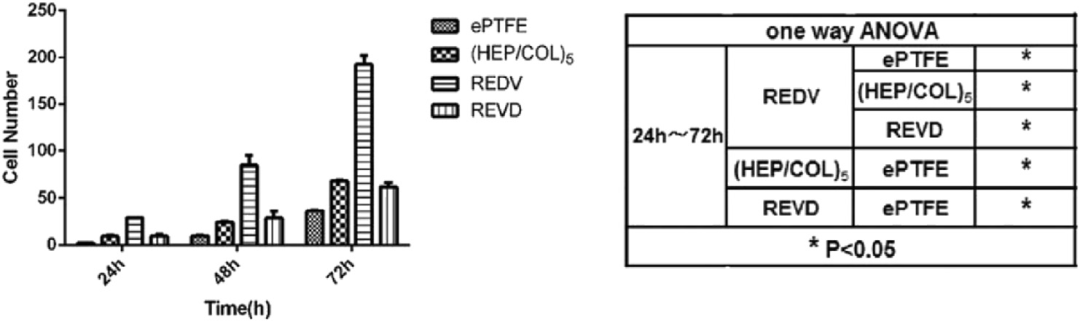
细胞接种也被描述为体外或体内模型避免血管移植并发症的有效手段。我们在此介绍对 12 只小型猪进行的动物模型研究:7 只对照未接种移植物,5 只接种移植物。自体内皮细胞是从带有细胞接种移植物的猪的隐静脉中收集的。然后将细胞接种在移植物的管腔表面并培养 48 小时。结果显示,6个月后,4个种子移植物(80%)获得专利,而只有2个对照移植物(29%)获得专利。VEGF165(生长因子)和 fibulin-5(细胞外基质糖蛋白)的内皮细胞表达对于它们在流动条件下的粘附和增殖是必需的;因此,开发了具有增强的 fibulin-5 表达的转导细胞。ELISA 测定验证了这些成分的表达,流动条件下粘附的体外评估显示与天然细胞相比,转导细胞的粘附显着改善。
对转导的自体内皮细胞采用相同的策略,增强的 VEGF165 和纤维蛋白 5 或前列环素的表达。在大型动物模型上进行的相同实验表明,在血管移植物中植入经过修饰的细胞进行选择性血管造影,结果显示,三分之一的天然细胞获得了专利。在血管移植物中进行细胞接种的完整最新技术是可用的。最近还描述了在用于人冠状动脉内皮细胞粘附的散装材料膨胀过程中 ePTFE 的官能化,以改善小血管移植物的通畅性。
然而,应谨慎解释和处理动物模型中的体外或体内细胞接种和自血管形成实验。事实上,动物模型并不能反映人类的愈合速度,因此可能会错过所进行研究的临床相关性。更重要的是,血管移植物的细胞接种,即使它在理论上可以改善移植物的通畅性,但在临床应用时从来都不够充分。问题可能在于对血管壁复杂生物学的不完全理解、植入的合成移植物造成的破坏以及与这种异物的相互作用。
获得专利的官能化工艺 (EP 1501565 B1) 使用密封剂和热塑性聚合物,即苯乙烯乙烯丙烯苯乙烯共聚物 (SEPS)。SEPS 用于在血管移植物的管腔表面涂上薄层。然后通过与羧基的共聚过程将涂层表面官能化,然后将羧基共价键合到硫酸乙酰肝素类型的半合成分子上。通过将半合成硫酸乙酰肝素涂层和未涂层的移植物植入绵羊的颈动脉来检测新内膜增生。未涂层的移植物在其管腔中显示出假内膜,而涂层的移植物则没有阻塞组织。
离子束改性 ePTFE 还显示出改善血液相容性移植物、促进细胞粘附和抑制血小板反应的前景。He+、Ne+、Ar+ 和 Kr+ 离子束用于以 150 keV 的能量修改 ePTFE 片材表面,通量从 1×10^14 到 1×10^15 离子/cm²。通过补充的富含血小板的血浆与改性或未改性的 ePTFE 接触进行血小板粘附测定。为 He+、Ne+ 和 Ar+ 离子束描述的一些注量条件阻止了血小板粘附,而除了 Kr+ 之外,其他这些离子像未改性的 ePTFE 一样促进了粘附。建议使用的不同条件会导致不同的表面结构或多或少地吸引血小板。对 ePTFE 修饰表面上内皮细胞生长的体外测定表明,每个修饰表面都能促进内皮细胞生长。
在先天性膈疝中,ePTFE 较差的粘附性能适用于腹部,但不适用于需要特定粘附和组织整合的胸部。在氧化条件下,多巴胺在 ePTFE 表面的自发粘附和聚合是用有利于细胞粘附的成分对膜进行不对称官能化的手段。事实上,Liu 等人。描述了通过修饰不同材料的聚多巴胺表面来改善细胞粘附的机制。PDA 也已用于其他医学应用,例如血管移植物。最近的一项研究将 PDA 与聚乙烯亚胺 (PEI) 沉积相结合,在表面产生胺基。PEI 的氨基随后与硫酸化两性离子聚合物偶联,作为第二层涂层。
PLGA 或聚己内酯等基于生化的聚合物也可以为细胞附着和生长创造有利的环境。一项研究设计了涂有 PLGA 沉淀物的 ePTFE 支架。然后将支架浸入溶解在氯仿中的 25% PLGA 溶液中,然后浸入甲醇溶液中以实现相分离。体外 MTT 测定表明,涂有 PLGA 的 ePTFE 被细胞定植的数量是纯 ePTFE 的八倍。
与骨骼接触的植入物,例如组织间隙填充物,将受益于更好的骨细胞材料相互作用。许多技术已经被研究过,例如羟基磷灰石的沉积、长脉冲、高频氧等离子体浸没 (PIII) 的离子注入处理,或含有二羟基苯丙氨酸 (DOPA) 的肽的吸附。另一种潜在的骨整合聚合物诱导羟基磷灰石 (HAP) 沉淀最近在模拟体液下进行了测试,试图使结果更可预测。似乎直链或支链聚丙烯酸或聚丙烯酸-共衣康酸的接枝诱导了 HAP 的沉淀,而交联聚合物处于磷酸盐和钙分离的不同相中。上颌骨手术中的引导骨再生膜也一直是创新官能化的关注主题。
ePTFE 是一种广泛用于生物医学应用的材料,这要归功于其机械、化学和生物相容性特性。与非共价键合相比,这篇综述中关于 ePTFE 共价键合的文章较少。这可以通过其强大的化学惰性来解释,只有少数激进技术才能改变。可以根据化学品的危险程度、我们可以使用的压力和温度来选择官能化策略。为了在医疗设备中的进一步应用,该策略还必须在行业上可行。这也可以解释为什么非共价键被进一步探索以改变ePTFE的表面性能,因为软化学在行业中受到青睐。
自 1990 年代初以来,ePTFE 制成的医疗器械已经过临床测试,多年来成功干预和术后随访不断增加。在血管、引导骨和组织再生、疝气修复或心脏修复手术等领域取得了重大进展。ePTFE 似乎是一种比用于相同目的的其他材料更有效或同等有效的材料,例如用于血管移植物的涤纶、生物可吸收聚合物引导的组织再生或用于支架的镍钛合金。
官能化 ePTFE 仍然是提高设备性能的研究途径,并适用于需要特定医疗特性的更多案例。官能化 ePTFE 的临床试验保持边缘存在,可以通过可以进入临床试验阶段的创新解决方案来改变。
聚合物生物材料的化学表面改性对于实现改性聚合物生物材料的前沿生物医学应用至关重要,主要包括防污材料和生物相容性材料。零星发表的文章描述了通过“接枝到”、“接枝自”和“接枝通过”策略接枝新链,特别是聚(甲基丙烯酸缩水甘油酯)的接枝。目的是通过亲水性乙烯基单体的SI-ATRP制备梳型共聚物刷。PTFE 的平面(薄膜)和非平面(管)表面的可扩展纳米纹理方法使用氧等离子体蚀刻机。该过程在管状和平面样品上产生具有高径向和轴向均匀性的半有序纳米柱结构,具有良好的体外杀菌和体内抗炎特性。
氟化聚合物(包括 PTFE)和部分氟化聚合物可以表现出智能特性,例如聚(偏二氟乙烯)及其共聚物由于其铁电和热电特性而代表了越来越多地应用的一类新型材料。特别是压电特性,即材料能够将电刺激转化为机械反应,反之亦然,在需要高度仪器化设备、人造肌肉致动器、高级组织工程和药物输送方法等生物医学领域引起了极大兴趣。尽管这些进展证明了这类智能聚合物的强大潜力,但要进行深入和动态的研究以获得特定的定制性能,这些性能肯定会在不久的将来满足一些最具挑战性的(生物)技术应用,还有很长的路要走 。在这种情况下,最近开发的用于生物医学应用的液体注入光滑表面是热门话题。光滑表面与生物医学领域相关,包括抗生物污染、抗血栓形成、医疗器械涂层和表面增强/辅助检测。
文章来源:东莞市富临塑胶原料有限公司











