上海医疗器械展会Medtec解读《AFM》:多功能钝化蛋白吸附涂层调节微环境实现血管支架快速愈合
2024-09-19
可生物降解支架为治疗冠状动脉疾病铺平了道路。然而,需要快速的再内皮化来解决降解速率不匹配、局部炎症和生物相容性不足的问题。近日上海医疗器械制造展Medtec了解到,来自四川大学生物材料国家工程技术研究中心的王云兵教授联合四川大学华西医院肾内科的付平教授团队利用双电子氧化,通过多巴胺、(-)-表没食子儿茶素没食子酸酯(EGCG)和铜离子(Cu2+)的配位螯合、氧化、交联、聚合和沉积,合成了一种新型钝化蛋白质吸附涂层(方案1)。该涂层表现出分级功能,即在宏观尺度上,其超亲水性传递了防污能力;而在微观尺度上,活性基团(醌基、氨基、羟苯基和芳香环)有利于蛋白质吸附。
相关研究成果以“A Versatile Passivated Protein-Adsorption Platform for Rapid Healing of Vascular Stents by Modulating the Microenvironment”为题于2024年1月4日发表在《Advanced Functional Materials》上。
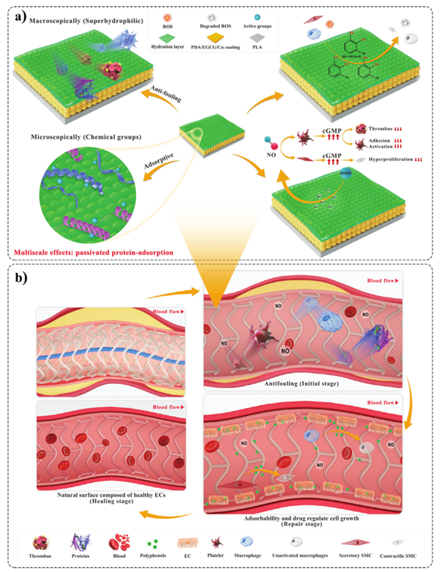
方案1 钝化蛋白质吸附涂层的多尺度效应和生物功能和促进体内支架再内皮化
1. 涂层的表征
在涂层沉积过程中,多巴胺、EGCG和CuCl2的混合溶液之间会发生各种化学反应(图1a)。在PDA反应溶液中,在高碘酸钠存在下,多巴胺的特征吸收峰从279 nm移动到286 nm(图1b)。相比之下,在PDA/EGCG/Cu反应溶液中,发生了多酚聚合和金属-多酚配位反应,总体结果是280 nm处的吸收峰位置没有变化(图1c)。根据反应过程中发生的动态(前10秒)和静态(20分钟内)颜色变化(图1d),PDA/EGCG/Cu的反应比PDA更强烈。SEM表明PDA和PDA/EGCG/Cu涂层由直径为10-20 nm的纳米颗粒组成(图1e),EDS光谱说明元素均匀分布在整个涂层中(图1f)。通过将样品放置在空气中不同时间并测试其接触角,发现两种涂层仍保持良好的润湿性。此外,由于铜离子与酚羟基的配位螯合以及水分子上阳离子的吸附,PDA/EGCG/Cu表面表现出更优异的长期超亲水性能(图1h)。
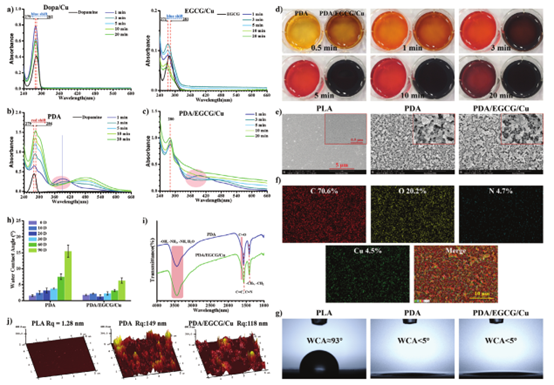
图1 涂层的基础表征
随后,作者用XPS研究表面元素的化学状态。PDA/EGCG/Cu的XPS谱表现出Cu吸收峰(图2a)。随着多酚EGCG的引入,C含量增加,而相对N和O含量下降(图2b)。此外,在磷酸盐缓冲盐水中动态释放120天后,涂层继续以生理有效浓度催化NO释放(图2f),证明了PDA/EGCG/Cu的长期催化NO释放能力。同时,PDA/EGCG/Cu涂层实现了Cu2+(图2g)和EGCG(图2h)超过30天的持续释放。EGCG显着增加了涂层中酚羟基的数量(图2i)。相应地,自由基清除能力也显着提高,表明PDA/EGCG/Cu涂层可以最大限度地减少氧化应激(图2j)。
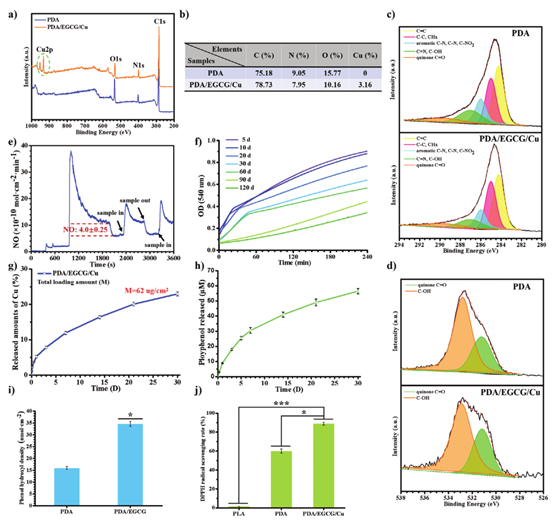
图2 XPS及涂层NO释放能力评价
2. 钝化蛋白质吸附特性
纤维蛋白原的吸附行为显着影响植入后病变的初始微环境,进而对医疗器械的寿命和功效产生关键影响。PLA、PDA和PDA/EGCG/Cu样品与FITC-hFg一起孵育4小时、1d和3d。从荧光图像(图3a)和强度(图3b)来看,PDA和PDA/EGCG/Cu样品几乎不发出荧光,表明由于水化层的存在,涂层的超亲水性有效抑制了纤维蛋白原的粘附。然而,随着孵育时间的增加,所有样品的荧光强度均增加,这表明纤维蛋白原不断吸附在表面上。与具有长效抗蛋白质粘附能力的传统超亲水防污表面相比,超亲水PDA和PDA/EGCG/Cu涂层仅减缓蛋白质吸附。因此,这些新型超亲水涂层被定义为钝化的蛋白质吸附涂层。
钝化的蛋白质吸附涂层,尤其是PDA/EGCG/Cu,有效地保持了吸附蛋白质的自然构象(图3c)。由于其金属阳离子和酚羟基含量的增加,PDA/EGCG/Cu比PDA具有更强的钝化蛋白质吸附作用。PDA和PDA/EGCG/Cu涂层均含有多种活性基团,可通过共价和非共价力促进蛋白质粘附。血液中的血浆蛋白将逐渐克服表面和H2O分子之间的结合能并粘附到暴露的活性基团上,导致支架表面上的蛋白粘附增加(图3e)。这种逐渐的蛋白质粘附可能促进EC在涂层支架上的生长。
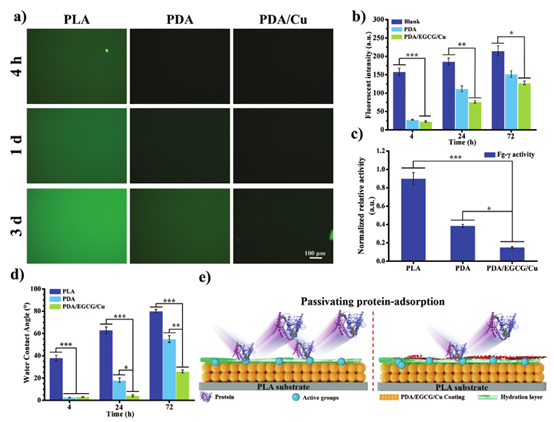
图3 PLA、PDA和PDA/EGCG/Cu样品的蛋白质吸附行为
3. 内皮细胞行为
健康的内皮细胞在维持血管微环境稳定方面发挥着关键作用。因此,作者评估了不同涂层在有和没有ROS刺激(300 μM H2O2)的情况下对EC生长的影响。观察粘附EC的形态证实EC可以在钝化的蛋白质吸附涂层上生长(图4a)。培养1天后的细胞扩散(图4b)测试表明,无论有或没有H2O2刺激,钝化的蛋白质吸附涂层上的EC生长均低于PLA表面的生长。添加H2O2后,PDA/EGCG/Cu表面上的ECs的状况明显好于PDA和PLA表面上的ECs,这表明多酚EGCG有效地清除ROS并将其对ECs的损害降到最低。通过CCK-8检测检测到的贴壁EC的吸光度值也证实了PDA/EGCG/Cu不仅促进EC生长,而且还保护EC免受ROS诱导的损伤(图4c)。
上海医疗器械制造展Medtec今年将重磅推出展前会——医疗器械设计与制造技术产业峰会 2024,由主论坛及4个分论坛组成。其中分论坛1:医疗器械公共政策及市场准入将邀请有关部门权威人士对以上各项法规进行探讨,以期帮助企业明确未来发展方向,并给出指导建议。如需报名参加展前会,敬请联系[email protected],上海医疗器械展会Medtec期待您的参与!您也可以报名参观,参与现场免费会议!
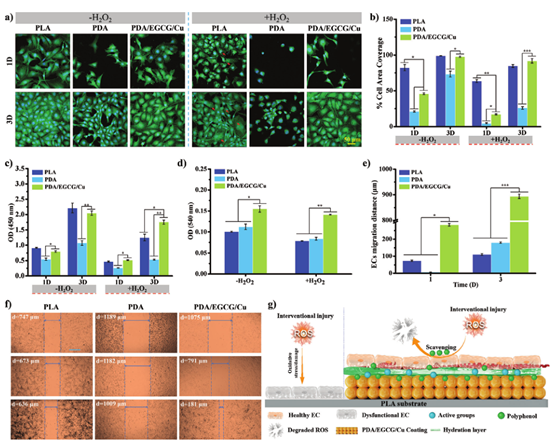
图4 PLA、PDA和PDA/EGCG/Cu表面上的EC培养
4. 抗炎和抗氧化应激特性
支架植入不可避免地导致病变血管再次损伤,引起局部炎症、氧化应激和血浆沉积。氧化应激和沉积的血浆不仅抑制血管中的细胞生长,还会引发急性炎症,从而影响组织损伤、重塑和修复。巨噬细胞在调节炎症反应、维持组织微环境稳态、血管修复和愈合方面发挥着至关重要的作用。粘附巨噬细胞的CLSM图像(图5a)表明巨噬细胞在无等离子体或H2O2刺激的情况下在PLA表面生长良好。在PLA表面,引入刺激后,铺展面积显着增加,证明尽管贴壁细胞数量减少,但大量巨噬细胞被激活。相比之下,PDA/EGCG/Cu表面上刺激后扩散面积的变化要小得多(图5b)。粘附巨噬细胞的吸光度证实H2O2的引入不会引起巨噬细胞凋亡(图5c)。荧光图像、细胞铺展面积和贴壁细胞的吸光度值表明PDA/EGCG/Cu涂层可以有效抑制巨噬细胞的粘附和活化。
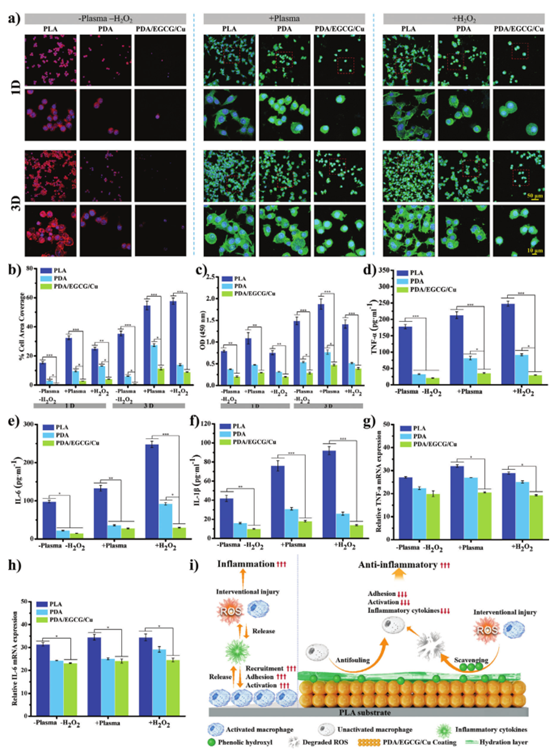
图5 PLA、PDA和PDA/EGCG/Cu表面的巨噬细胞培养
5. 血液相容性
受损的血管和吸附的血浆蛋白诱导血小板活化、粘附和聚集。同时,活化的血小板增强炎症反应并引起凝血级联反应,导致SMC增殖、表型改变并迁移至内膜。因此,有必要分析不同样本上血小板的状态来评价其血液相容性。孵育1小时后,在所有条件下都有几个血小板粘附在PLA表面,并且大多数处于完全激活的铺展状态(图6a)。相比之下,由于钝化的蛋白质吸附平台的抵抗作用,在未刺激组的PDA、PDA/EGCG/Cu或PDA/EGCG/Cu+SNAP涂层上几乎没有观察到血小板。NO释放行为证实PDA/EGCG/Cu可以催化SNAP分解释放生理浓度的NO,从而抑制血小板粘附和活化。结果,PDA/EGCG/Cu+SNAP表面表现出最小的血小板粘附和未活化的血小板,这证实了NO通过SNAP分解的作用显着抑制了血小板粘附和活化。总体而言,血小板粘附测试证实PDA/EGCG/Cu涂层在钝化蛋白吸附和NO的共同作用下具有优异的体外血液相容性。
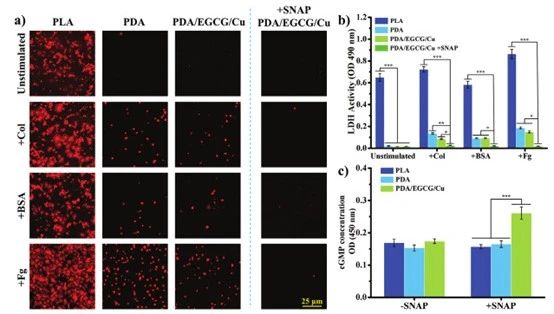
图6 PLA、PDA和PDA/EGCG/Cu样品的体外血液相容性
6. 体内血管支架植入
最后,作者将PLA、PDA和PDA/EGCG/Cu支架植入新西兰白兔腹主动脉3个月(图7a)。通过组织病理学切片,观察到PLA和PDA支架表面的新生内膜狭窄分别达到30%和22%,显着高于PDA/EGCG/Cu支架的9%(图7b)。通过SEM观察支架上新内膜的形态(图7c)。H&E染色结果与SEM观察结果一致,即PDA/EGCG/Cu涂层在抑制新内膜增生方面比PDA涂层和裸PLA表面更有效(图7d)。免疫组化染色结果表明,PDA/EGCG/Cu涂层支架的新生内膜组织处于稳定状态,有效抑制支架内再狭窄。
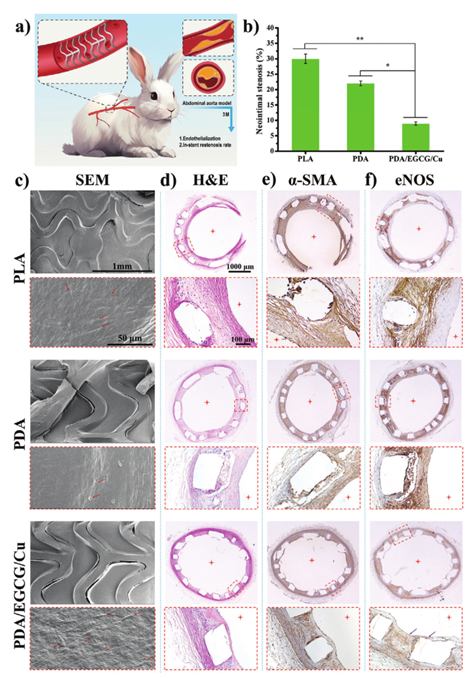
图7 体内血管支架的植入及其染色结果
综上,上海医疗器械制造展Medtec小编总结一下,本研究构建了一种多功能涂层,新型涂层包含亲水性聚多巴胺(PDA)/EGCG/Cu复合纳米颗粒。新型超亲水表面充当钝化的蛋白质吸附涂层。血管细胞(EC、SMC 和巨噬细胞)的血液相容性和细胞培养评估表明,钝化的蛋白质吸附涂层可抑制血小板、巨噬细胞和SMC的粘附、活化和聚集,同时促进EC的迁移和生长。该涂层具有出色的生物功能,可抵抗支架内再狭窄,并促进体内植入后支架内膜的快速修复。该研究为生物可降解支架功能表面修饰提供了重要的新理论和思路。
文章来源:
https://doi.org/10.1002/adfm.202312243











