Medtec中国展观察Nature Photonics–成像新技术:“超声发光成像”
2024-03-01
医学成像技术是现代医学中不可或缺的一部分,它通过各种成像设备和方法,使医生能够直观地观察和评估患者体内的器官和组织,而无需进行侵入式手术。这些技术包括X光、超声、核磁共振成像(MRI)、计算机断层扫描(CT)和正电子发射断层扫描(PET)等。超声成像是利用高频超声波来可视化人体内部,没有电离辐射损伤,是一种广泛应用、低成本、实时、非侵入性和安全的成像模式。基于这些优势,超声波具有作为激发分子发光的能量源的潜力。
分子成像是一种非侵入性的工具,用于可视化和定量分子和细胞生物过程,进疾病的检测、诊断、预测和监测。光学成像是分子成像的一个重要组成部分,具有灵敏性高、特异性高和可实时检测等优势。目前,可通过光、化学/生化相互作用、放射性同位素或X射线等手段激发分子发光。然而,依赖实时光激发的荧光成像往往受到组织自发荧光的影响,降低了活体组织成像灵敏性和特异性。相比之下,化学发光、生物发光、Cerenkov发光或X射线激发发光,可以消除生物组织中的自发荧光。然而,生物发光或化学发光信号往往受到活体中酶微环境或底物分布的影响。Cerenkov发光或X射线激发发光成像通常需要高剂量的放射性同位素或X射线才能达到足够的成像对比度,这可能对正常组织造成损伤。
Medtec中国展了解到超声成像是利用高频超声波来可视化人体内部,没有电离辐射损伤,是一种广泛应用、低成本、实时、非侵入性和安全的成像模式。基于这些优势,超声波具有作为激发分子发光的能量源的潜力。声致发光是一种在高强度超声作用下,液体空化而产生的微弱发光现象,然而,其发光效率低、发光强度弱、超声暴露时间长,发光寿命极短。“声致发光”是指当液体被高强度超声波空化时发生的微弱光发射。在声空化过程中,气泡的膨胀和收缩与声压同步,产生高温(可达10000K)和高压(81 MPa)的气泡坍塌。剧烈的气泡振荡诱导了羟基自由基的形成,有时还伴随声致发光的发射。尽管早在1934年就报道了瞬态声空化产生的声致发光现象,但由于这种光发射是在极端条件下产生的,且发光效率和强度极低(约50计数/秒),声致发光并未被认为是一种有效的成像技术。
一项最新研究在成像领域得了重要进展,为生物医学成像技术的发展开辟了新的可能性。最近,Medtec中国展了解到湖南大学宋国胜教授、张晓兵教授和谭蔚泓院士成功开发出一种创新的“超声发光成像”技术,利用超声波激发荧光分子在活体内产生发光信号,实现了高强度的光学信号输出的成像新方法。这一技术不仅胜过水自身声致发光,还具有更小的背景噪音、提高的信噪比、成像灵敏度和成像深度,相比传统荧光成像具有多项优势。研究团队通过两步内部能量转换过程,实现了更强的在活体内的超声诱导发光成像。点击立刻报名参展
研究结果显示,超声诱导荧光的强度超过了声致发光,同时还展现出更好的信噪比、成像灵敏度和成像深度。相较于传统的水的声致发光信号,该工作开发的超声激发发光分子在发光强度上提高了2000余倍;与荧光成像相比,超声激发发光成像由于超声信号和光学信号发射之间不存在信号串扰,信噪比提高了10倍,同时具备1.46毫米的空间分辨率和高达2.2厘米的组织穿透深度。该工作同时开发了两种成像模式来采集超声激发分子发光的信号:在超声激发停止后采集光子信号的延迟成像模式,和在超声激发期间采集光子信号的实时成像模式。随后,研究团队展示了该技术对皮下和原位脑肿瘤、原位胰腺癌、腹膜转移肿瘤和淋巴结进行体内成像的可行性。这一技术不仅提供了高质量的成像结果,还具有无辐射操作、手持式激发、易于使用、安全且不需要昂贵仪器等多个关键优势,为生物医学成像领域带来了突破。此外,研究团队还提出了一种酶活化的超声诱导荧光探针设计,通过不同酶可切割的肽序列作为连接剂,实现了对酶动态活动的成像。这种技术为定制各种酶响应型超声诱导荧光探针提供了一个多功能平台,为生物医学研究和临床诊断带来了新的可能性。上述成果在光学顶级国际期刊《自然光学》Nature Photonics(IF=35.0)上面发表名为《In vivo ultrasound-induced luminescence molecular imaging》的论文。
超声成像技术因其无创、成本低廉、操作简便和实时成像的特性,在医学临床诊断中被广泛使用。它通过超声波的传输、反射和散射原理,映射出人体内部结构的图像。超声波在不同组织界面上的反射差异,使得医生能够观察到器官的形态和功能状态,常用于心脏病、肝脏疾病、妇科检查和产科监测等领域。然而,传统的超声成像技术在分辨率和对比度上有限,尤其在分子水平上检测疾病标志物方面存在挑战。为了提高超声成像的灵敏度和特异性,超声分子成像技术应运而生。它利用靶向对比剂来增强病变区域的超声信号,从而实现疾病早期诊断和治疗效果监控。超声分子对比剂通常包括微泡、纳米粒子等载体,这些载体表面可以修饰具有亲和力的分子,如抗体、肽或者小分子药物,使其能够特异性结合到病理改变的组织或细胞上。目前,超声分子成像面临的挑战包括:对比剂的稳定性、靶向性、生物分布、以及信号强度等。微米级含气微泡作为常见的超声对比剂,尽管增强了血管内的超声信号,但它们的大尺寸限制了其在组织间隙中的分布,难以到达血管外的病理区域。此外,高强度的超声波可能导致微泡破裂,影响成像效果并可能引起不良生物效应。
Medtec中国展了解到未来超声发光成像技术和医学超声成像有望实现更高级别的集成,通过同时检测声学光子信号和超声图像,将提供更全面的疾病信息。这种集成策略不仅能够在没有背景噪声的情况下进行成像,而且还能够在分子水平上提供关于病理过程的信息,从而显著提高分子成像的灵敏度和准确性。预期未来超声分子成像技术将有助于实现活体内组织病理学病变的研究、早期肿瘤检测、生物分子的分析、癌症治疗和预后的监测、心肌缺血的成像、肠道疾病的炎症活动成像以及动脉硬化的评估等。这些应用的成功不仅将改善疾病的诊断和治疗,还将推动个性化医疗和精准医疗的发展。

图1、(a)各种发光分子的化学结构。(b)纳米粒子的制备示意图。(c)TD纳米粒子的代表性TEM图像。(d)纳米粒子的实物照片。
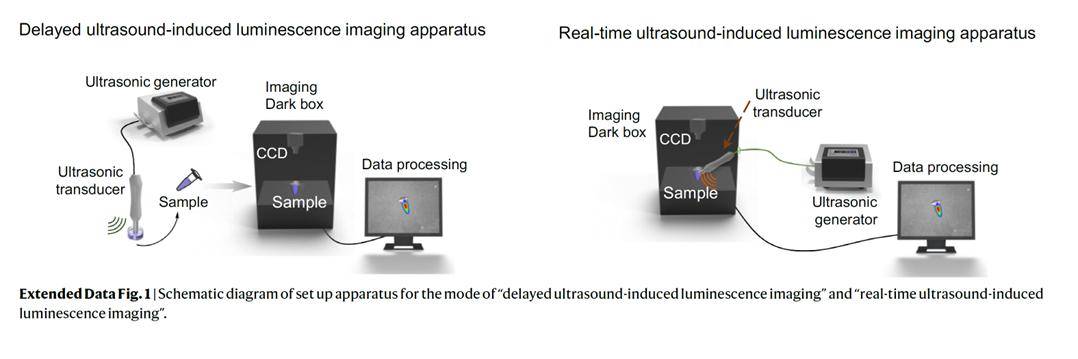
图2、延迟超声激发分子发光成像模式(左)和实时超声激发分子发光成像模式(右)实验装置示意图。
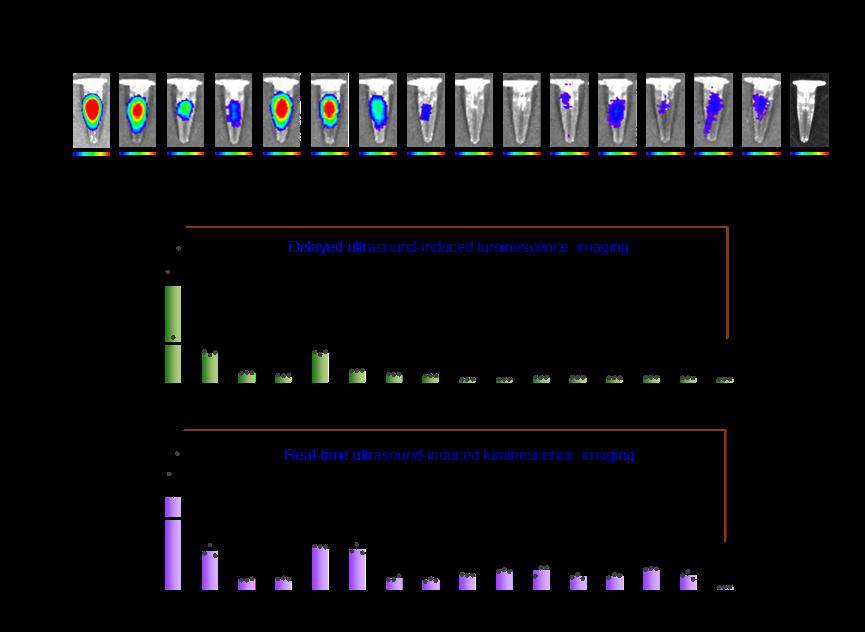
图3、(a)延迟超声激发分子发光成像模式下各个纳米粒子的发光图。(b)延迟超声激发分子发光成像模式和(c)实时超声激发分子发光成像模式下的纳米粒子发光强度定量图。
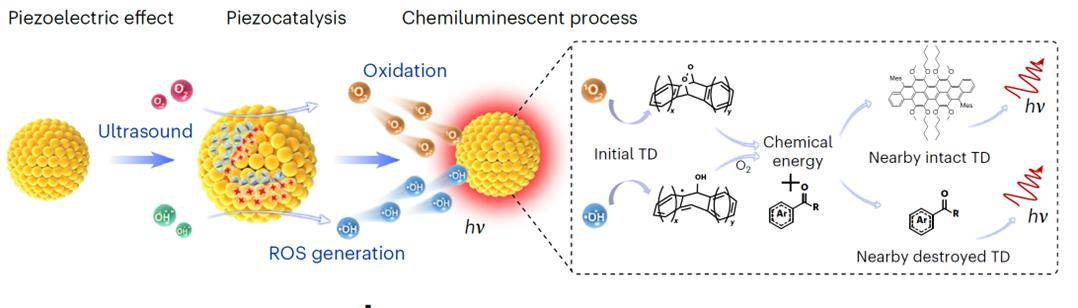
图5、TD NPs的超声激发发光机理示意图。
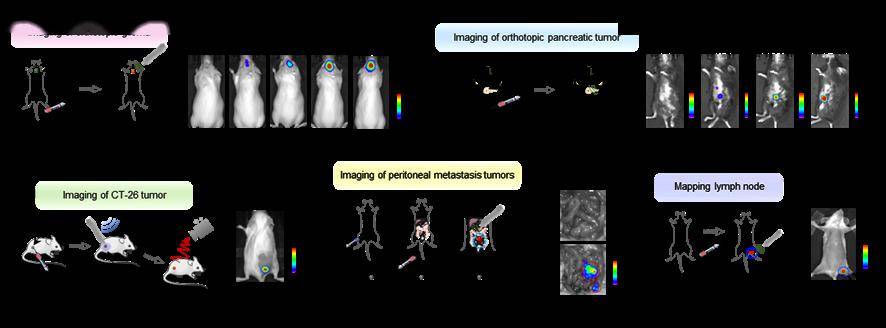
图6、超声激发发光成像小鼠(a)原位脑胶质瘤、(b)原位胰腺癌、(c)皮下瘤、(d)腹膜转移瘤和(e)淋巴结。
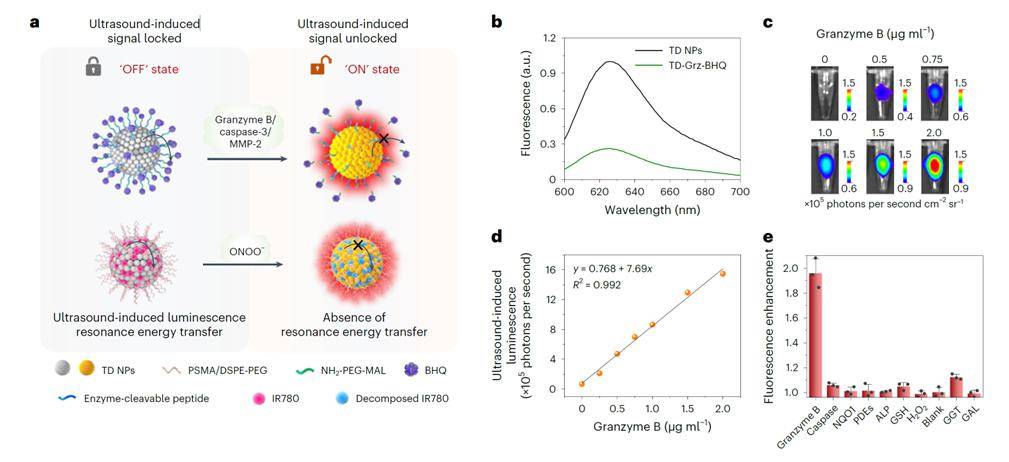
图7、酶响应的超声激发分子发光探针检测示意图。
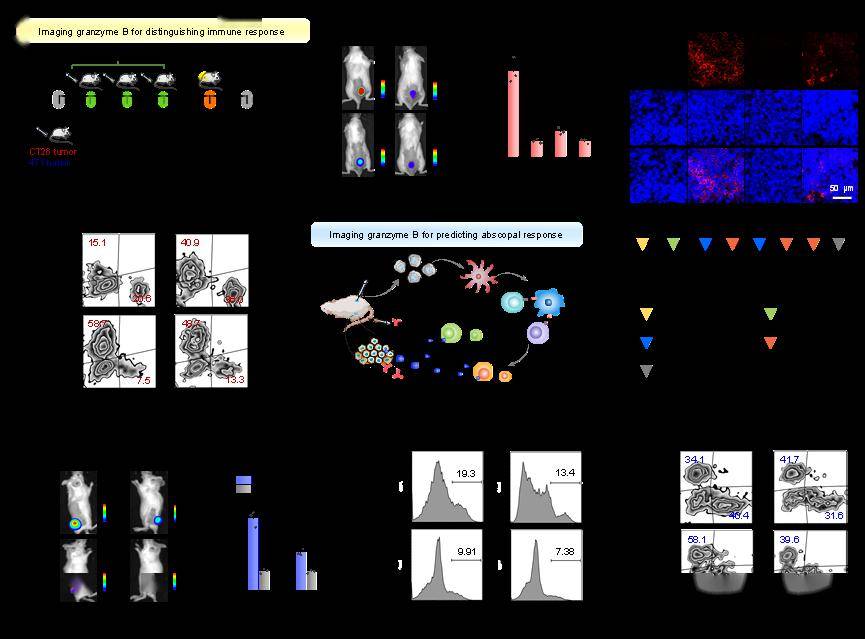
图8、颗粒酶B响应的TD-Grz-BHQ超声激发分子发光探针成像不同类型小鼠接受免疫治疗后肿瘤部位颗粒酶B的含量(a-d)、小鼠接受免疫治疗后的远端效应(e-h)。
在本研究中,首次实现了通过两步内粒子能量转换过程达到强烈且体内的超声发光成像。这种超声光子成像信号可以通过两种模式收集:超声激励停止后的延迟超声发光成像和超声激励期间的实时超声发光成像。值得注意的是,超声发光成像的强度明显高于声致发光,并且与实时光学激发不同,它几乎没有背景噪声。与传统荧光成像相比,超声发光成像提高了信噪比、成像灵敏度和成像深度。此外,与X射线激活的发光、生物发光或切连科夫发光相比,超声发光成像为体内成像提供了几个关键优势,包括无辐射、手持激发、操作简便、安全以及不依赖昂贵的仪器。因此,超声发光成像能有效地映射皮下肿瘤、原位胶质母细胞瘤、腹膜转移瘤和淋巴结。
文章来源:奇物论











