国际医疗器械展览会Medtec谈新兴生物传感技术在POCT的潜在应用
2024-08-20
随着我们对生命科学、分子生物学、纳米技术、光学、电化学等领域认识的加深,近年来出现了越来越多的生物传感器设计策略,能够为各种人类疾病的即时诊断提供潜在的实际应用。与传统生物传感器相比,最新的POC生物传感器研究旨在提高传感器精度、成本效益和时间消耗,并开发多功能检测策略,以实现在单个设备中进行多重分析物检测,并实现快速诊断和高通量筛选。本文结合CRISPR技术、电化学生物传感以及基于光学或光谱的生物传感的最新进展,描述了POC识别和转导(2018-2021年)的各种有趣策略。从推动新兴生物分析工具在POC检测和诊断应用中应用的视角出发,总结了近年来该领域取得的主要进展,并对未来POC的发展和挑战提出了自己的看法。
-
本文是主题合集的一部分:2022 年最受欢迎的化学生物学文章和 2022年化学科学观点与评论合集
从2019/2020年开始的持续全球爆发的COVID-19不仅使数十亿人感到恐慌,而且还引起了公众对早期发现传染病重要性的关注。1–3因此,许多研究机构和公司正在努力开发有效的方法来快速检测 SARS-CoV-2 RNA、抗体、抗原和病毒,以帮助识别和隔离感染患者。1,4,5无论测试是使用胶体金纳米颗粒 (AuNP) 制成的设备还是聚合酶链反应 (PCR) 进行,它们都被视为床旁 (POC) 检测,它被定义为一种使用快速分析和准确诊断的方法在患者床边附近产生临床相关输出,从而允许医护人员或患者自行做出临床决策。6–10在过去的几十年里,生物传感技术通过利用大量新型材料取得了重大进展,这些材料是各种生物传感应用中特别有用的平台。11–19例如,金纳米材料是在Si/Au/Si上制造的3N4用于检测循环肿瘤DNA、蛋白质和其他种类的生物靶标的芯片。20此外,响应式光学纳米材料作为纳米光学中最活跃的研究领域之一,可以通过颜色或光谱变化来检测生物标志物,从而实现POC检测。16这些新开发的方法在灵敏度、选择性、实用性方面优于传统检测方法,最重要的是,在欠发达和资源有限的地区实现 POC 应用的潜力。21,22
理想情况下,POC系统应尽量减少用户操作以消除错误,易于使用,具有检测某些临床生物标志物所需的灵敏度,选择性和准确性,能够直接从自检中产生诊断结果,并且对于大多数家庭来说足够便宜。23,24世界卫生组织热带病研究和培训特别规划(WHO/TDR)提出了一套理想的诊断工具标准,称为“有保证”(负担得起的、敏感的、特异的、用户友好的、快速和强大的、无设备和可交付给最终用户的)。25,26这些标准已成为开发生物传感器的黄金标准,尤其是那些适用于资源有限地区的 POC 测试的传感器。然而,目前主流的生物分子定量技术,包括质谱 (MS)、ELISA、蛋白质印迹法和北方印迹法,都非常昂贵、复杂且耗时,因此不适合当今评估各种人类疾病所需的即时护理。8,27–29作为回应,基于场效应晶体管、基于荧光的生物传感器、表面等离子体共振 (SPR) 传感器和电化学生物传感器的 POC 方法应运而生,这是电化学、化学生物学、化学和工程领域快速科学努力的结果。18,30,31
如图 1 所示,POC 设备通常由目标、探头、传感工具、换能器和信号读出设备五部分组成,前三个基本元件因生物分子固定化、信号转导和设备集成的最新发展而得到增强。32,33简而言之,生物靶标首先由探针以选择性方式识别。接下来,该识别过程由特定的换能器转换为体外信号,然后显示在数字平台上。总体而言,POC器件的选择性取决于第一步,而灵敏度主要由后续步骤决定。34
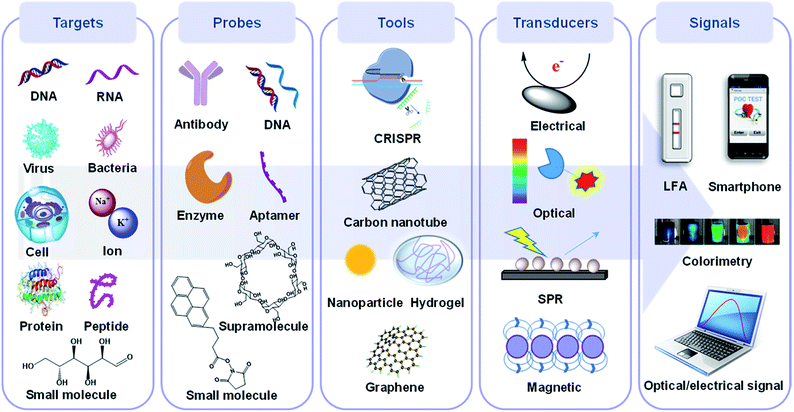
图1 POC设备的组件包括潜在目标、探头、传感工具和传感器、信号采集和处理及其相应的元件。生物靶标主要由核酸、全细胞、细菌/病毒颗粒、蛋白质和小分子组成,而探针通常包含合成或天然抗体、寡核苷酸、蛋白质和其他超/小分子。传感工具主要是指传感材料和平台,如纳米材料、水凝胶和CRISPR。传感器将探头识别转换为信号,然后显示在可读设备上。
国际医疗器械展览会Medtec不仅汇集全球企业,提供产品研发、生产、注册所需的设计及软件服务、原材料、精密部件、自动化制造设备、超精加工技术、合同制造、测试和认证、政策法规和市场咨询服务,同时展会现场还有十数场专业会议,议题涵盖医疗器械的研发设计、高端有源医疗器械的最新技术、光电部件在医疗中的应用、国内外法律法规、市场投融资情报分析等。报名参观即可与行业大咖近距离会面,机不可失!点击此处报名预登记>>>
近年来,随着化学、生物、材料科学、微电子学及其交叉学科的快速发展,针对不同疾病的POC技术日新月异。越来越多的方法正在转化为实用产品,例如用于检测妊娠的侧向层析测定 (LFA) 和用于检测糖尿病的便携式设备。其中,DNA/RNA、抗体、超分子等通常用作探针,以提高检测阶段的特异性,而比色法通常用作信号转导方法,使POC检测更加直观。除了这些已用于 POC 检测产品的成熟技术外,还有一些新开发的策略有可能适用于新一代 POC 诊断。在此,我们回顾了这一充满活力的研究领域取得的进展,重点关注过去四年(2018 年至 2021 年)开发的潜在基于化学的 POC 识别和转导技术的关键进展,包括用于传感阶段的革命性成簇规则间隔短回文重复序列 (CRISPR) 和用于 POC 策略转导阶段的基于电化学/光学的技术。我们进一步按靶标类型对基于CRISPR和电化学的技术进行分类,并根据其增强可视化的机制对基于光学的生物传感器进行分类,例如表面增强拉曼散射(SERS),SPR,荧光,比色法及其杂交体。本文重点介绍的工作主要集中在传感工具、信号传感器和相应的读出平台上。我们将在传感工具一节中重点介绍基于CRISPR的POC系统,因为与传统的传感工具相比,最近在这一领域已经做出了相当大的努力。因此,重点介绍了 POC 系统在电化学和光学领域的尖端技术,因为它们是使用最广泛的转导方法,产生了大多数创新,并且最接近实际的 POC 应用。本小型综述的目的是:(1)重点介绍基于上述技术及其最新进展的一些有趣的POC应用;(2)在选定的创新研究领域的基础上,概述其POC发展现状;(3)讨论上述方法的缺点;(4)对本研究领域存在的挑战进行总结并提出一些观点。
基于CRISPR的POC检测
不同CRISPR-Cas系统POC传感的构建和切割活性
CRISPR-Cas系统存在于大多数细菌和古细菌中,由CRISPR相关(Cas)核酸酶和向导RNA(gRNA)组成,它们共同作用,通过切割核酸赋予对外来病毒的免疫力。38–40在新兴的 POC 应用中,2 类 CRISPR-Cas 系统的 Cas9(II 型)、Cas12(V 型)和 Cas13(VI 型)应用最为广泛,原因很简单,只需要一个单一的、RNA 引导的、多结构域的 Cas 蛋白来组装 CRISPR 效应复合物。41,42如表1所示,尽管所有三种类型的CRISPR系统都被归类为2类,但它们的靶向核酸不同;Cas9 和 Cas12 系统特异性靶向 DNA,而 Cas13 系统靶向 RNA。gRNA 由两部分组成,第一部分是可编程的 CRISPR RNA (crRNA),可识别并与靶核酸序列杂交,第二部分是与 crRNA 结合并引导核酸酶切割 DNA 的反式激活 RNA (tracrRNA)。在II-Cas9型系统中,crRNA和tracrRNA都是必需的,而V型和VI型系统只需要一个crRNA即可实现上述功能。38,43,44靶标识别的第一步包括分别通过Cas9/Cas12和Cas13识别特定的原间隔区相邻基序(PAM)和原间隔区侧翼位点(PFS),然后评估靶标中的序列互补性。这种两步靶标识别过程确保了比主要依赖于序列互补性的传统核酸探针更高的选择性。成功识别靶标后,所有 2 类 CRISPR-Cas 系统都利用相应核酸酶的靶向(顺式切割)或侧支切割(反式切割)来执行后续信号转导事件。45
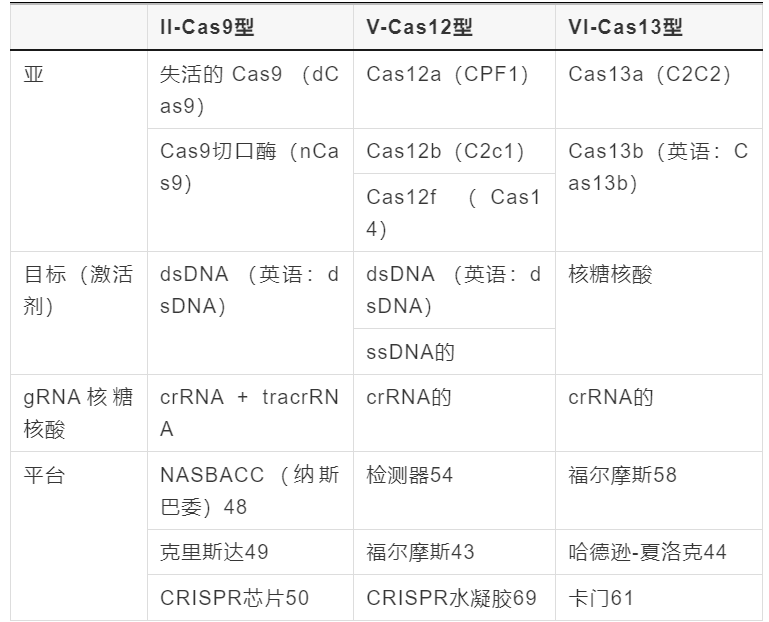
表1 本文总结了Class-2 CRISPR-Cas系统的主要特点和具有代表性的POC传感平台
Cas9、Cas12 和 Cas13 可以实现顺式裂解,而 Cas12 和 Cas13 也能够进行侧支裂解。41从 POC 测试的角度来看,这种类型的侧支切割活性有可能通过产生易于放大的输出信号来促进生物标志物的快速准确检测。通过修饰gRNA序列,CRISPR-Cas系统可以引导Cas蛋白切割任何感兴趣的序列。总之,这两个关键特性(即可编程靶标识别和信号放大)使CRISPR-Cas系统成为核酸、小分子、蛋白质、金属离子等POC检测的通用工具。
用于核酸POC检测的顺式和反式裂解活性
PCR和DNA测序方法的发展使得快速准确地诊断许多传染病和遗传疾病成为可能,并监测其治疗效果。46然而,这些方法在成本、灵敏度、选择性和效率之间进行了权衡。因此,迫切需要能够对核酸进行高灵敏度和选择性单碱基检测的策略。幸运的是,CRISPR-Cas系统因其高可编程性和准确的基因编辑能力,为这些问题带来了新的解决方案。40在本节中,我们根据表1所示的CRISPR-Cas系统的不同分类,重点介绍了最新的基于CRISPR的POC技术,用于检测核酸。
2016年,Doudna和Collins独立提出并展示了使用CRISPR-Cas系统检测RNA的新方法。47,48Doudna的研究报告称,C2c2(Cas13a)酶具有两种不同的RNase活性,即顺式和反式切割活性,它们协同工作以提供强大的RNA检测和降解能力。在Collins及其同事报告的另一项研究中,等温RNA扩增与脚趾开关RNA传感器一起使用,以检测临床样本中的寨卡病毒。当与CRISPR-Cas9模块结合使用时,报告的传感器可以将病毒株区分到单碱基水平。此后,基于Cas9的创新传感平台相继建立,如2018年的CRISDA和2019年的CRISPR芯片。49,50CRISDA能够扩增和传感双链DNA(dsDNA),具有双链DNA的敏感性和基于链置换扩增方法的单碱基特异性;49然而,扩增过程无疑会增加整个检测周期的检测复杂性和时间(>3 h)。为了实现开发易于操作的 POC 设备的最终目标,应强调无扩增策略。CRISPR芯片通过结合具有高靶向能力的CRISPR-Cas9和具有高灵敏度的石墨烯场效应晶体管(gFET),实现了对未扩增靶基因的检测。50
COVID-19是由SARS-CoV-2引起的大流行,截至2021年9月15日,确诊病例超过2.265亿例,相关死亡病例超过460万例。51Xiong等人提出了一种基于CRISPR/Cas9介导的三线侧向层析测定(LFA)的SARS-CoV-2同步双基因检测诊断方法。52如图2A所示,使用多重逆转录-重组酶聚合酶扩增(RT-RPA)分别在病毒的开放阅读框1ab(Orf1ab)和包膜(E)基因上用地高辛和生物素标记拭子样品。通过与 AuNP-DNA 探针连接的 Cas9 鉴定后,可以通过固定在 LFA 测试线内的地高辛抗体和链霉亲和素检测该复合物。该平台能够在单个 LFA 中同时检测两个基因,每次测试 (25 μL) 的灵敏度为 100 个 RNA 拷贝,在快速周转时间 (<1 小时) 内完成 SARS-CoV-2 检测,阴性和阳性结果的预测一致性为 100% 和 97.14%,尽管调整了扩增过程。尽管作者已改用LFA检测过程,但如果要实现非专家检测,仍需要解决复杂的扩增过程。
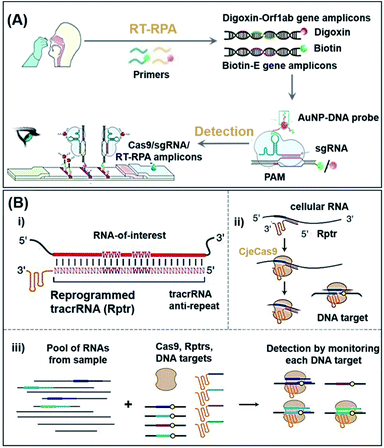
图2 CRISPR-Cas9 支持的潜在核酸 POC 传感平台。(A) RT-RPA同步扩增SARS-CoV-2和LFA传感反应机理示意图。转载自参考文献。52经许可。版权所有 2021 Wiley-VCH。使用RT-RPA,扩增提取样品的E基因和Orf1ab基因区域,并分别用生物素和地高辛标记。在典型的测试中,上述复合物被滴到样品垫上并允许流动到偶联垫,在那里AuNP-DNA探针与支架序列杂交。最后,由于AuNPs的积累,可以用肉眼观察到彩色条带。(B) 用于平行RNA检测的多路复用LEOPARD平台概述。(i) Rptr的设计过程;(ii)NcrRNA生成过程;(iii)目标RNA的多重检测过程方案。Rptrs 将检测到的 RNA 转化为 ncrRNA,这将引导 Cas9 匹配 DNA。然后,DNA序列的Cas9结合或切割表明样品中存在感测到的RNA。转载自参考文献。53经许可。版权所有 2021 美国科学促进会。
通常,tracrRNA与crRNA的杂交推动了CRISPR-Cas9系统的运行。然而,Jiao等人最近发现,tracrRNA也可以与细胞RNA杂交,从而形成“非经典”crRNA(ncrRNA),能够进一步引导Cas9靶向随后的DNA。53如图2B所示,由于能够通过重编程的tracrRNA将任何感兴趣的RNA与DNA靶向连接起来,这一新发现使开发一种称为LEOPARD的可多路复用诊断平台成为可能,用于平行RNA检测[图2B(iii)]。在概念验证演示中,作者表明,LEOPARD应该具有进一步发展成为新一代CRISPR-Cas9平台的潜力,用于POC检测,在单个反应中具有可扩展的多重特性。
如表1所示,V型(Cas12a)和VI CRISPR(Cas13a)都可以实现顺式和反式切割,并通过使用非特异性核酸切割作为换能器产生电化学或光信号来简化POC生物传感器的应用。基于这些特征,Doudna的团队开发了一种称为DNA核酸内切酶靶向CRISPR反式报告基因(DETECTR)的诊断系统,该系统可用于使用Cas12a快速轻松地实时检测临床样本中的少量DNA。54RPA/RT-RPA 扩增 DNA/RNA 使其更容易被 Cas12a 识别,随后 Cas12a 任意切割附近的 ssDNA,使报告分子发出荧光,即使在混合样品中也能实现核酸的高效检测(图 3A)。Chiu 等人报道了一种基于 DETECTR 的检测方法,该方法使用从 COVID-19 患者拭子样本中提取的 RNA 来识别 SARS-CoV-2。55在对从病毒 RNA 反向转录的 DNA 进行等温扩增后,通过 CRISPR-Cas12 反式切割检测 SARS-CoV-2 的 E(包膜)和 N(核蛋白)基因以释放报告分子,从而证实了病毒的存在(图 3B)。与RT-PCR检测相比,该方法的阳性和阴性预测一致性分别为95%和100%。此外,RT-PCR 测试通常需要 24 小时以上才能检测到 SARS-CoV-2,并且需要专门的设备和实验室,而 DETECTR 只需要两个固定的工作温度,并且可以在 ∼45 分钟后提供视觉读数,类似于家庭妊娠试验。作者列出了运行该方案所需的最低设备,其中包括带试剂的 Eppendorf 管、加热块或水浴(37 °C 和 62 °C)、无核酸酶水、移液器和吸头以及侧向层析试纸。此外,复杂的RNA提取过程和扩增过程中的加热要求是该技术在家庭中使用之前必须解决的挑战。已发现二价阳离子可加速 Cas12a 激活步骤和 DNA 切割过程中的前 crRNA 过程。56基于这一理论,马等人首先筛选了几种二价阳离子,发现锰离子的促进作用最大。之后,作者使用锰增强的Cas12a(MeCas12a)将测试的crRNA的信号增强了13倍,从而可以在不需要专门设备的情况下检测RNA片段的个位数拷贝。57
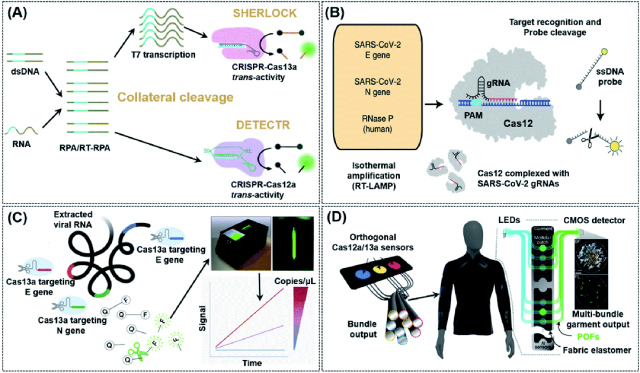
图3 基于CRISPR-Cas12/Cas13的生物传感策略用于核酸检测。(A) 典型的基于侧支切割的 CRISPR-Cas 系统、SHERLOCK 和 DETECTR 的示意图。当 crRNA 与核酸靶标结合时,Cas 蛋白的反式切割活性被激活,导致多个报告分子的切割以实现检测。(B) SARS-CoV-2 的 DETECTR 工作流程示意图。常规RNA提取被用作DETECTR的输入,通过荧光阅读器或侧向层析试纸进行可视化。该检测采用 RT-LAMP 对从通用转运培养基 (UTM) 中的拭子中提取的 RNA 进行同步逆转录和等温扩增,然后对预定义的冠状病毒序列进行 Cas12 检测并切割报告分子以确认病毒检测。转载自参考文献。55经许可。版权所有 2020 Springer Nature。(C) 用于组合靶向病毒 RNA 多个区域的 crRNA 的免扩增定量检测方法,可通过便携式基于手机的设备提高对 SARS-CoV-2 的敏感性。通过结合多个 crRNA 以增加 Cas13a 活化,该检测可以在紧凑型设备中使用手机摄像头分析荧光随时间的变化,该设备包括低成本激光照明和收集光学器件,而不仅仅是终点荧光。裁判。62经许可。版权所有 2021 Elsevier Inc. (D) 基于 CRISPR 的可穿戴设备的设计。服装活性的分布式连续传感可以通过多束成像来实现。携带来自不同传感器的输出发射信号的各种光纤可以路由到一个束中,用于集中成像分析。裁判。64经许可。版权所有 2021 Springer Nature。
基于Cas12a可用于检测具有反式切割活性的RNA的发现,Zhang的团队还在2017年使用Cas13开发并优化了另一种传感策略,称为特异性高灵敏度酶报告基因解锁(SHERLOCK)。58在他们的研究中,作者证明SHERLOCK能够在各种人类样本中识别寨卡病毒,登革热甚至一些癌症相关突变的RNA序列。然而,该技术存在一些局限性,包括无法量化目标以及严重依赖荧光检测器进行信号读出。为了克服这些缺点,同一小组开发了SHERLOCK第2版(SHERLOCKv2),该版本具有更高的灵敏度,并且能够使用侧向层析读数进行定量和多重检测。59SHERLOCKv2 涉及从不同种类的细菌中引入多种 Cas13 酶,例如 LwaCas13a 和 PsmCas13b。SHERLOCKv2 的工作方式与 DETECTR 类似,只是需要特定的荧光报告基因。SHERLOCKv2 特异性的提高使其能够同时检测多个序列。与DETECTR类似,SHERLOCKv2也采用了等温核扩增技术来提高检测灵敏度。通过将CRISPR III型Csm6酶作为活化物质引入系统,进一步扩增了检测信号。
受 SHERLOCK/SHERLOCKv2 成功的启发,还开发了其他基于 CRISPR-Cas13 的策略来检测 SARS-CoV-2 和埃博拉病毒。35,60有效的病毒检测方法需要同时检测多种病毒株,以预测病毒的快速突变。然而,大多数常规检测方法不具备这种能力。此外,它们不容易扩展,因此不适合像 COVID-19 这样的大流行。为了解决这些问题,Ackerman等人开发了组合阵列反应,用于核酸的多重评估,称为CARMEN-Cas13。61该检测方法成功地将CRISPR-Cas13的核酸检测与微阵列技术相结合。CARMEN-Cas13 还具有可重复使用性和成本效益,使作者能够同时检测和区分 ≥10 个已发表的基因组序列中的 169 种人类相关病毒。尽管如此,上述基于Cas13a的大多数方法要么依赖于复杂的仪器进行信号读出,要么需要单独的信号放大步骤,从POC的角度来看,这些问题将需要在未来得到妥善解决。最近,Fozouni 等人提出了一种无需扩增的方法,只需从安装在手机上的紧凑型显微镜读取信号,即可从鼻拭子 RNA 中定量检测 SARS-CoV-2(图 3C)。62通过采用多种crRNA,该方法具有高灵敏度,能够在30 min内检测到每μL样品约100个拷贝的RNA,并且还可以在5 min内灵敏地检测预提取的靶RNA。该检测方法可能接近于成为RNA靶标(例如来自SARS-CoV-2的靶标)的新一代POC检测方法。由于移动技术和可穿戴电子材料的快速发展,可穿戴传感器也被认为是POC系统的新发展机会。34,63需要进一步努力将这项工作完全转变为广泛可用的即时护理设备。核心问题是样品制备的免萃取方案。在Collins等人最近的一项研究中,作者将CRISPR-Cas系统集成到冻干无细胞(FDCD)可穿戴平台(Fig. 3D)中。64传感机制基于SHERLOCK,但具有能够分别使用Cas12a和Cas13a检测DNA和RNA的附加特性。通过多束成像,基于织物的可穿戴POC设备能够从金黄色葡萄球菌中连续检测三种常见的耐药标志物。基于该系统设计的口罩能够在 1.5 小时内方便地检测 SARS-CoV-2,检测限 (LoD) 为 500 拷贝 (17 aM)。这种设计有很多方面值得借鉴,例如不需要手动擦拭样品;然而,检测时间过长的问题仍需解决。
用于蛋白质、小分子和金属离子POC检测的反式裂解活性
除核酸外,蛋白质和小分子等其他诊断生物标志物对POC检测也很重要。由于其强大的可编程性和基因识别能力,特别是具有侧支切割特性,CRISPR-Cas已被用于间接检测各种非核酸靶标。下面我们总结了基于CRISPR的蛋白质、小分子和金属离子POC检测的主要机制(图4A),所有这些都基于分子翻译的概念。其基本原理是通过靶分子释放或结合CRISPR-Cas系统的触发,从而分别激活或限制Cas蛋白中的侧支切割活性,并最终提供荧光(FL)或电读出信号。图4A(i)–(iv)分别使用设计的适配体(用于小分子/蛋白质/肽)、DNA酶(用于金属离子)、调节蛋白(用于小分子)和寡核苷酸(用于蛋白质)来表示传感过程。

图4 基于CRISPR的策略,用于检测非核酸靶标。(A) 基于CRISPR的非核酸靶标POC检测的分子翻译机制。(B) 使用手持式便携式设备检测 fDNA 调节的三磷酸腺苷 (ATP) CRISPR-Cas12a 传感器的策略和工作流程。在ATP存在下,靶标与fDNA结合可以诱导DNA激活剂与fDNA解杂,并成为与Cas12a结合并激活的“开放激活剂”。转载自参考文献。65经许可。版权所有 2020 美国化学学会。(C)CRISPR-Cas13a辅助蛋白质高通量检测的CLISA方案。捕获抗体首先与目标抗原结合,然后是链霉亲和素与生物素-dsDNA 模板连接的生物素化检测抗体。转录后,扩增的 RNA 激活反式切割,从而进行检测。转载自参考文献。68经许可。版权所有 2020 美国化学学会。
Xiong等人最近报道了一种新型CRISPR-Cas12a传感器,该传感器由功能DNA(fDNA)分子(如适配体和DNA酶)调控,可特异性检测非核酸靶标,包括小分子和金属离子。65如图4B所示,ATP的识别导致激活剂(fDNA链)从适配体-激活剂复合物中解锁。Cas12a随后识别出释放的DNA激活剂并进行反式切割。活化的非特异性ssDNA核酸酶进一步裂解两侧的淬灭-ssDNA荧光报告基因(FQ-reporter),最终产生荧光信号。通过使用便携式荧光阅读器,作者表明,在室温下不仅可以快速检测血清中的ATP,而且可以快速检测血清中的Na(<15分钟),表明该设备适用于POC检测。根据作者的说法,该传感器原则上可以进一步扩展,用于快速和高灵敏度地检测蛋白质,病毒甚至细胞。与小分子和金属离子类似,蛋白质也可以被CRISPR系统检测到。Dai等人利用CRISPR-Cas12a系统(E-CRISPR)开发了一种通用的电化学生物传感器。+66在这项研究中,首先用固定浓度的适配体(可以与蛋白质靶标结合)处理靶蛋白。接下来,设计Cas12a-crRNA特异性识别适配体,最后应用电信号,基于非特异性DNA报告基因的反式切割间接确定靶标特异性适配体的剩余浓度。通过使用这种电化学检测,作者能够检测LoD为0.2 nM的蛋白质。Liang等人基于图4A(iii)所示的类似机制开发了CaT-SMelor平台(CRISPR-Cas12a-和细菌变构转录因子介导的小分子检测器)。67在存在小分子靶标的情况下,调节因子和靶标之间的竞争性结合可以释放Cas12a的触发dsDNA,从而切割FQ报告基因并允许定量小分子的浓度。强大而无处不在的抗体-抗原相互作用是开发通用生物传感器的有用工具。Chen等人提出了一种通用的CRISPR-Cas13a信号扩增连接免疫吸附测定法(CLISA),用于检测femtomolar浓度的蛋白质。68如图4C所示,作者首先使用固定在96孔微孔板中的抗体来捕获相应的蛋白质抗原。接下来,使用与生物素-链霉亲和素-生物素-dsDNA复合物连接的检测抗体来识别蛋白质抗原。通过 T7 RNA 聚合酶对 dsDNA 进行信号扩增后,CLISA 对人白细胞介素-6 和人血管内皮生长因子的 LoD 值分别为 2.29 fM 和 0.81 fM。
响应式水凝胶的使用在各种生物技术应用中至关重要,从组织工程的支架设计到检测不同目标生物分析物的生物传感器。例如,对 DNA 有反应的水凝胶非常适合与合成或天然存在的 DNA 相互作用。然而,现有的DNA响应性水凝胶需要使用高浓度的DNA触发器进行驱动。为了适应修改后的触发器的插入,需要重新设计水凝胶系统,这可能导致与其结构要求发生冲突。有鉴于此,English等人设计了一种基于CRISPR的可编程DNA水凝胶传感器,该传感器可以根据用户定义的核酸序列进行定制。69在靶标传感过程中,该技术利用Cas12a的反式切割能力切断了嵌入水凝胶中的DNA之间的联系,从而导致水凝胶水解。通过使用这种CRISPR响应的智能水凝胶,作者进一步证明了其他靶标的成功释放,包括预先锚定在DNA中的小分子、酶、纳米颗粒和活细胞,从而表明这些水凝胶可用于未来此类靶标的POC检测。
CRISPR无疑为POC诊断领域注入了新的血液。然而,由于大多数Cas蛋白的脆弱性,基于CRISPR-Cas的POC产物的储存和运输对其稳定性提出了严格的要求。尽管有报告显示,通过将CRISPR-Cas系统嵌入纸质设备中,可以将CRISPR-Cas系统的存储温度提高到约20°C,但制造基于CRISPR-Cas的POC检测试剂盒及其营销仍面临关键挑战。
电化学传感领域已经非常成熟,但近年来,随着与纳米技术、生物技术以及目标识别和信号转导中的许多其他新兴策略的成功融合,POC诊断领域得到了加速发展并被赋予了新的生命。在POC器件设计中,基于电化学的策略主要与换能器部分相关,并负责将目标传感转换为电化学读数。电化学传感器按其信号产生模式可分为五种主要类型,包括伏安/安培、阻限、电导、电位和场效应晶体管(FET)生物传感器。70一般来说,无论生物传感器的类型如何,电信号都是由探针和目标之间的物理或化学反应产生的,随后在信号变化的基础上实现目标的定量/半定量/定性检测。
在本节中,我们将介绍各种电化学传感器开发的最新进展,这些传感器用于检测适用于POC设置的各种目标。作为一种比较成熟的转导技术,电化学技术已经应用到实际的POC应用中,71,72例如血糖仪。73然而,电化学技术在一些急需的诊断领域使用仍然存在一些挑战需要克服。首先,由于电化学信号的敏感性,体液中无关分子的干扰对结果的准确性有很大影响。然而,大多数生物标志物的丰度低于干扰分子的丰度,这导致许多疾病和癌症的早期筛查生物传感器的稀缺。其次,目前POC实现多重检测的发展目标还存在问题。以往该领域的综述主要集中在传感器材料或机理的分类和讨论上,74–80因此,在这一部分中,我们重点介绍了一系列新开发的方法,这些方法成功地解决了传统电化学生物传感器以前面临的挑战,特别是简单制造、超灵敏度、复杂样品检测和多重靶标检测。70,81,82我们专注于核酸、蛋白质和细菌/病毒的生物靶点,因为它们是疾病早期诊断和多重筛查中最重要的生物靶点。此外,由于各种电(信号)转导系统的成本效益,70,83如线性扫描伏安法和差分脉冲伏安法,整个传感系统可以很容易地应用于资源有限的地区。简言之,电化学生物传感系统的最新发展以积极的方式促进了其在全球医疗保健系统中的广泛应用。本节也分为两部分,一部分用于核酸,另一部分用于其他类型的生物标志物。
核酸的电化学检测
临床样本中核酸浓度极低,需要相应的生物传感器具有高灵敏度和特异性,以区分特定序列和相关分子。84Kelley及其同事率先使用电化学方法检测核酸。70,85–88在一个经典的例子中,作者开发了所谓的中和剂置换测定(NDA),在所有主要类别的核酸中都具有破纪录的灵敏度。85,87他们还开发了一种微创疾病诊断策略,该策略采用DNA离合探针(DCP)来检测循环肿瘤DNA(ctDNA)中的突变,LoD为1fg μL−1.88通过使用 Si3N4以/Au/Si电极和合成分子如肽核酸(PNA)为探针,这些方法利用电位电化学信号产生灵敏的读数。尽管该设计对ctDNA突变具有出色的灵敏度和选择性,但检测循环核酸的一个关键挑战是将多个突变位点与血液样本中高度表达的野生型序列区分开来。随后,作者提出了一种基于组合探针的高通量ctDNA电化学生物传感策略。20该方法被证明是一种有效的检测方法,通过在 30 分钟内直接定量人血液中的多个携带突变的核酸序列,具有 POC 应用的潜力。
基因电路的发展为设计新型生物传感器提供了新的思路。由于许多基因回路位于活细胞中,因此由此产生的生物传感器是可再生的、高选择性的、易于生产且具有成本效益的。89在无细胞系统中,基因电路传感器也可用于浓缩基因转录和翻译所需的酶。90以前,这种传感器依赖于光学报告蛋白,这些蛋白在一次反应中最多只能产生三个报告基因信号,因此限制了它们测量多个不同信号的能力。为了克服这一局限性,Mousavi等人开发了一个基于电化学信号的平台,该平台允许对无细胞基因电路生物传感器进行多路复用报告。91如图5A所示,该系统包括纳米结构的金电极、固定在电极表面的捕获DNA,以及以游离状态存在于系统中的退火报告基因DNA。在靶 RNA(触发 RNA)存在的情况下,脚趾开关 RNA 被打开并翻译,使 RNA 编码的限制性内切酶能够被翻译以识别和切割报告基因 dsDNA。由于 ssDNA 和捕获 DNA 之间的结合自由能较低,因此产生的结合是稳定的,因此驱动亚甲蓝 (MB) 靠近金电极通过电子转移机制产生电流。这种新型电化学界面能够检测由小分子驱动的合成基因网络,并使用设计的检测芯片对粘菌素抗生素耐药基因进行多重检测,进一步证明了这种新型电化学界面。
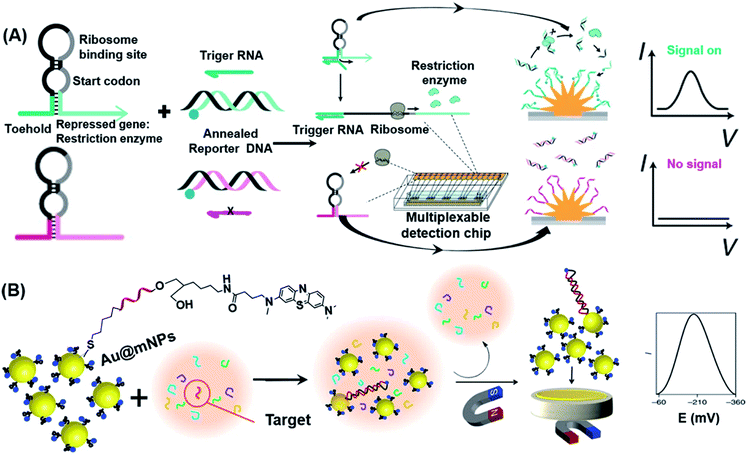
图5 核酸检测中使用的基于电化学的POC策略。(A) 将无细胞转录和翻译系统与纳米结构微电极上的工程基因电路相结合的合成基因检测方法的方案图示。简而言之,这种方法采用基于脚趾开关的 RNA 传感器,该传感器将在触发 RNA 存在的情况下表达十种基于限制性内切酶的报告基因之一。之后,限制性内切酶切割退火的报告基因DNA,然后释放用氧化还原报告基因标记的报告基因DNA(蓝色圆圈)。在纳米结构微电极上通过探针DNA捕获报告基因DNA后,会产生电化学信号。转载自参考文献。91经许可。版权所有 2020 Springer Nature。(B) 使用Au@mNPs检测miRNA所涉及的步骤的示意图。Au@MNPs用亚甲基蓝标记的探针 DNA 修饰,该探针 DNA 与靶 miRNA 互补。在Au@MNPs从溶液中磁分离后,未杂交的序列被洗掉。金微电极表面上的磁性收集Au@MNPs(杂化和非杂化)提供电化学信号。转载自参考文献。93经许可。版权所有 2018 Springer Nature。
MicroRNA (miRNA) 是一类非编码 RNA,长度为 18-24 个核苷酸,通过充当肿瘤抑制基因或癌基因与肿瘤的形成密切相关。它们可以通过与靶基因3′UTR完全或不完全配对来降解靶基因的mRNA或抑制其翻译,从而参与个体发生、凋亡、增殖和分化等生命活动的调控。因此,它们代表了癌症的一些最重要的生物标志物。92Tavallaie等人报道了一种通过修饰镀金磁性纳米颗粒来灵敏检测miRNA(在未处理的血液样本中低至10 aM至1 nM)的策略,这些磁性纳米颗粒用作miRNA特异性DNA的可分散电极(Au@mNPs,图5B)。93在血液循环过程中,Au@mNPs捕获的靶miRNA可以被磁性隔离并转换为可测量的电信号,以便直接从血液中检测miRNA。因此,这种类型的传感器在未来只需用手指刺破即可确定miRNA水平方面具有很大的希望。
在上述两个例子中,利用这种纳米结构为POC应用设计生物传感器的一个问题是,材料的可重复性可能会在检测结果中产生偏差,因此研究人员可能更有兴趣探索未来如何解决这一问题。
除了上述生物传感器外,还有其他用于检测核酸的电化学策略,例如利用免疫磁珠和选择性DNA杂交来检测肿瘤抑制基因的甲基化,不仅来自原始血清和肿瘤细胞,而且来自病变组织。83Alafeef等人开发了一种具有数字电化学输出的石墨烯-ssDNA-AuNP平台,用于实时监测SARS-CoV-2。84该方法的灵敏度为 231(拷贝数/μL)−1检测限为每μL6.9拷贝,无需进一步扩增。随着遗传学和电化学科学的进步,我们非常乐观地认为,未来将有更多基于电化学的核酸检测方法被报道出来。
非核酸的电化学检测
电化学方法是一种可行的POC策略,用于检测蛋白质、小分子和细菌。94–96检测这些分子最常用的探针是适配体、抗体和酶。根据他们之前的研究,97Kelley的团队设计了一种肽介导的电化学空间位阻杂交测定法,98可用于检测 LOD 为 10 nM 的 HIV-1 gp41 蛋白抗体。由于该设计的基于 DNA 的信号转导机制是稳健的,并且鉴于 PNA 作为连接肽(抗原)与 DNA 链的接头的多功能性和模块化,该方法可能很容易适用于检测具有已知肽表位的其他抗体。最近,Kelley的团队报道了一种新的无试剂电化学传感方法,该方法基于巧妙设计的倒置分子摆的运动,其场诱导的传递由结合分析物的存在调节(图6A)。99,100通过使用附着的报告分子的电子转移动力学来测量传感器的电场介导的传递,作者能够检测到 LoD 为 1 pg mL 的心肌肌钙蛋白和 SARS-CoV-2 刺突蛋白−1(∼40 fM)。此外,作者还证明,这种机制不仅可用于检测血液、眼泪、尿液、唾液和汗液中的生物分子,还可用于检测活体动物中的生物分子(即原位检测),方法是用时间分辨的电化学曲线表征分子摆运动。
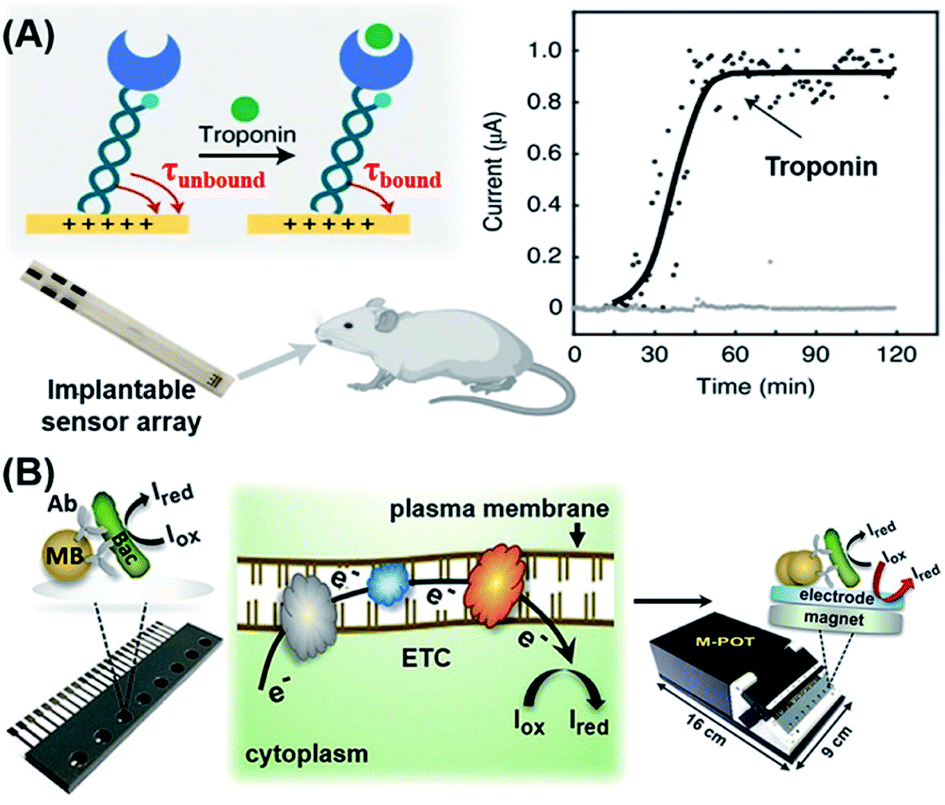
图6 基于电化学的POC生物传感器,用于检测蛋白质和细菌。(A) 通过监测由 dsDNA、特异性抗体和氧化还原报告基因构建的分子摆复合物的转运动力学,用于蛋白质检测的无试剂电化学生物传感器。这种方法依赖于表现出场诱导输运的倒置分子钟摆的运动。运动由结合分析物的存在调节,结合分析物通过传感器的电场介导的传输进行量化。转载自参考文献。99经许可。版权所有 2021 Springer Nature。(B) 用于检测细菌感染的免疫亲和安培法的工作流程,该方法由三个步骤组成:(1)从复杂基质中捕获和富集细菌;(2)化学还原和(3)电化学读数。转载自参考文献。106经许可。版权所有 2018 Wiley-VCH。
细菌感染,尤其是血液循环中的细菌感染,对人类健康构成严重威胁。抗菌药物的滥用和过度使用导致细菌耐药性增加,从而增加了细菌感染和传播的风险。因此,迫切需要对细菌感染进行POC检测。101为了检测血液中的细菌感染,近年来基因分型技术的进步大大加快了病原体的鉴定。然而,大多数现有的诊断方法仍然严重依赖耗时的抗菌培养方法。102–105Zhu等人最近开发了一种灵敏的免疫亲和安培法,可以在几个小时内检测细菌感染。106在他们的传感器设计中,首先使用已用相应抗体功能化的超顺磁珠 (MB) 从复杂基质中捕获和富集细菌病原体(图 6B)。随后,引入了合适的代谢活性指标,这些指标经历了化学还原(I牛到我红)在代谢活性细胞质膜上的呼吸电子传递链(ETC)中存在珠捕获细菌的情况下。所有这些反应都发生在一个包含多个恒电位仪的微芯片中,这些恒电位仪可以产生电化学信号,由读出设备直接读取。该方法可作为临床环境中细菌种类的快速高通量检测、活细胞定量和抗生素敏感性测试的有用参考。
上述各种检测策略概述了鲁棒电化学生物传感器的一些最新发展,以方便检测大多数类型的生物分子,并可作为未来现场诊断系统构建的有意义的参考。此外,本文描述的传感、识别和转导元件的各种创造性组合也有助于为未来POC检测系统的开发开辟新的机会。现在可以通过具有不同激活的多个探针同时实现多路复用电化学信号。因此,可以设计下一代电化学生物传感器来识别更多具有可微分电位的电化学氧化还原物质。此外,电化学平台中使用的集成探针的稳定性和活性应进一步提高,因为大多数现有方法在重复使用后可能导致生物分子活性显着下降。
光信号是最重要和最直观的检测信号。通过测量光学信号的变化,可以定性、半定量和定量地检测测试样品中生物分子的浓度,并具有出色的可见性。光信号是通过反射、衍射或吸收外界光或荧光、淬灭、化学发光等方式产生的。16,107–111与其他系统不同,光学生物传感器不需要复杂的仪器,在某些情况下甚至可以实现非侵入性和肉眼检测,使其比其他系统更具成本效益。112例如,光信号可以通过数码相机、智能手机相机或光电探测器数字化为可读图像。113,114然后,可以使用适当的成像软件对信号进行处理和分析,该成像软件将像素密度转换为检测区域内目标分析物的定量结果。因此,随着便携式光谱仪的发展,光学检测被认为是最适合POC检测的方法,也是最方便的肉眼检测方法。然而,由于光信号强度、检测仪器精度和光学读数器信噪比(SNR)较差等方面的局限性,体外光学检测的应用仍然面临重大挑战。34为了将光学生物传感器开发成合适的POC器件,研究人员在探针灵敏度、信号转导方法、传感材料制备、信号增强和降噪方面进行了改进。在本节中,我们通过不同的光信号产生方式回顾了光学POC诊断的最新进展。
基于结构颜色的光学POC传感器
结构色,也称为物理色,是由入射光的光衍射和反射产生的特定结构产生的。115产生结构颜色的结构通常由光子晶体 (PC) 组装而成,光子晶体由空间排列的周期性介电材料组成,这些材料独特地改变了光的传播,从而在特定波长下产生高效反射。116光缆、传感器和量子计算机都可以从 PC 结构中受益。117,118水凝胶被认为是重要的传感材料,因为它们易于化学修饰,与生物分子交联,并且可以对声学、光学、电磁、pH 值和其他类型的刺激做出反应。119,120由于与其他现有的生物分析方法相比,生物传感器具有众多优势,因此与PC技术和水凝胶相结合的生物传感器在这一领域具有很大的前景。自从 Asher 及其同事首次演示将 PC 与通过扩大或收缩来调节光子带隙的智能水凝胶相结合以来,121已经报道了多种基于PC水凝胶(PCH)的生物传感器,有可能被开发成POC设备,用于检测多种类型的生物标志物,如葡萄糖、凝集素蛋白、激酶、循环肿瘤细胞、有害离子、霉菌毒素、白色念珠菌和核酸。113,122–131这些创新研究清楚地证明了基于结构颜色的策略在新型POC器件开发中的有效性。然而,目前的PCH生物传感器都设计为仅将探针分子固定在水凝胶中。这些基于PCH的生物传感策略需要由于分子间键合而使水凝胶的体积或折射率发生较大变化,从而严重限制了可能检测到的分析物类型,并使其不适合在POC诊断中更广泛地使用。我们首先报道了一种基于竞争的概念,即通过使用抗体-抗原相互作用来设计PCH生物传感器(图7A)。132通过使用非共价键同时在水凝胶中引入抗原-抗体对,所得到的基于竞争的PCH生物传感器是通用的,与目标分子的类型无关,并产生可以通过目视观察和使用智能手机定量检测的颜色变化。更重要的是,该策略在激酶-磷酸酶活性检测和肽磷酸化中的应用证明了其在检测生物体液中蛋白质翻译后修饰(PTM)方面具有广泛的发展潜力。
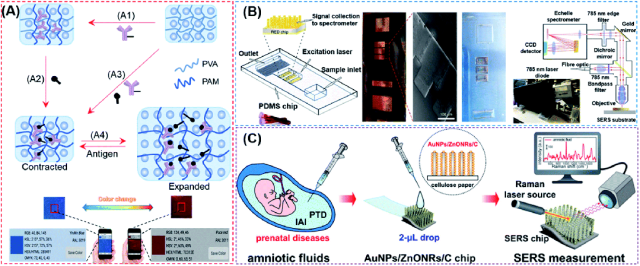
图7 (A) 使用抗体-抗原相互作用的基于竞争的通用光子晶体水凝胶生物传感器的整体制造和工作流程。光子晶体水凝胶传感器用抗体-抗原复合物修饰,两者在支架水凝胶上共价连接。游离靶标检测后,固定化抗体与抗原之间的断裂将导致水凝胶从收缩状态显着膨胀和颜色变化,肉眼和智能手机可以检测到。这种通用设计使肉眼和智能手机能够成功定量检测小分子、肽和蛋白质。转载自参考文献。132经许可。版权所有 2020 美国化学学会。(B) 用于TBI生物诊断的快速POC微工程设备技术。左图显示了该设备的结构。中间的图显示了用于制造PDMS的铜母的光学图像和SEM图像,以及输入1-2滴全人血液的微流控装置的照片。简而言之,全血将通过光流体芯片实验室分离到血浆中。微加工SERS芯片增强的光学信息被发送到PC,以使用设计的便携式光谱仪显示收集到的光谱。转载自参考文献。135经许可。版权所有 2020 Springer Nature。(C) 用于羊水SERS分析的AuNPs/ZnONRs/C芯片,以检测产前疾病。程序如下:收集羊水;将 2 μL 羊水滴入 AuNPs/ZnONRs/C 芯片并进行实时拉曼测量。转载自参考文献。136经许可。版权所有 2018 美国化学学会。
由于水凝胶的柔韧性,PCH有可能用于可穿戴设备。然而,由于缺乏可延展的电子传感器,在使用这种可穿戴PCH生物传感器时,很难进行可量化的测量。为了解决这个问题,Snapp等人详细介绍了一种具有光电量化的比色传感器,该传感器基于一个皱巴巴的石墨烯光电换能器上的PC集成系统。118虽然他们的研究主要集中在应变检测上,但作者指出,光子传感元件和可变形传感器在此类设备中的新颖组合可以为可穿戴和视觉生物传感器的设计提供新的视角。上述大多数研究都可以作为未来开发能够对各种生物分析物进行POC检测的更复杂的PCH传感器的有用参考。由于该结构色具有无光漂白和信号稳定性优异的优点,只要光子晶体传感器能够合理地嵌入到灵敏和便携式矩阵中,这种类型的生物传感器就可以为POC系统的开发提供新的选择。
基于SERS的光学POC传感器
1974年,Fleischmann等人发现,当与银电极密切接触时,吡啶的非弹性散射会大大增强。133从那时起,SERS光谱因其高精度、窄拉曼光谱宽度、分析时间短以及易于利用材料进行表面改性而成为超灵敏检测的有前途的分析工具。还可以设计多功能SERS传感器。134尽管一些研究者认为SPR引起的局部电磁场增强是SERS的机理,但目前仍难以准确理解和一致接受。因此,我们将讨论使用SERS和SPR检测机制的POC生物传感器的最新发展。
传统的基于SERS的生物传感器需要相对较长的样本采集周转时间才能获得可操作的结果。构建可现场部署的诊断平台和配套诊断设备也很困难。在此基础上,Rickard等人报道了一种传感策略,即通过将SERS与光流体装置相结合,快速和无标记地检测具有皮摩尔LoD的生物流体中创伤性脑损伤(TBI)的生物标志物。135如图7B所示,作者使用电流体动力学制造的亚微米柱构建了SERS活性基板,随后将其集成到光流体芯片中,然后使用等离子体活性纳米金层涂覆柱。使用由此产生的设备,可以立即从手指点刺血液样本中检测到 N-乙酰天冬氨酸,这是一种潜在的生物标志物,可用于构建 SERS 设备,并可用于未来的现场和实时目标检测。值得注意的是,作者设计了一种小型化拉曼系统,用于生物标志物的多重和高通量分析。
通过改变SERS基板的纳米结构,可以提高基于SERS的器件的灵敏度和精度,以增加增强因子。Kim等人报道了一种用SERS功能化的芯片,通过在纤维素纸上垂直生长的ZnO纳米棒(ZnO NR)阵列上装饰金纳米颗粒(AuNPs)(图7C)。136所开发的纳米结构被证明可以将拉曼信号增加 1.25 × 107具有出色的再现性。在将设计的传感器与多变量统计衍生的机器学习训练的生物分类方法进一步集成后,作者能够检测亚临床羊膜内感染 (IAI) 和早产 (PTD) 患者中痕量的人羊水浓度。通过使用硝化纤维纸作为基材(也经常用于其他SERS设备),137由此产生的基于SERS的生物传感器可用作一次性和低成本的POC设备。上述策略在检测芯片和检测设备方面比其他常规的SERS方法更方便,但它们仍然需要专业人员的操作。
基于表面等离子体共振的光学POC传感器
等离子体是自由电子在光刺激下在金属表面上振荡时发生的现象。当入射光的频率与表面电子的频率相同时,可以实现共振,这些电子在对其正核的吸引力下振荡,这称为SPR。138,139SPR已被用于各种生物传感和生物成像方法,通过增加荧光信号与背景噪声的比率来有效提高荧光标签的亮度。这种在两种介质界面处的光的增强和限制使等离子体平台非常适合制造POC诊断设备。138,140,141
Singamaneni等人最近设计并合成了超亮等离子体荧光团,作为等离子体增强荧光免疫测定中的增强荧光报告基因。142等离子体荧光团由与210 IRDye 800CW荧光团共价偶联的牛血清白蛋白组成,聚合物涂层的金纳米棒(AuNR)充当等离子体天线,允许高度集中的光照射到纳米颗粒周围的荧光团中,从而增加荧光团的发射率(图8A)).这种等离子体荧光团的荧光强度比包含单个荧光团的传感器的荧光强度高约6700倍。与对照免疫测定相比,等离子体-荧光基团联动免疫测定的检测限提高了 4750 倍。
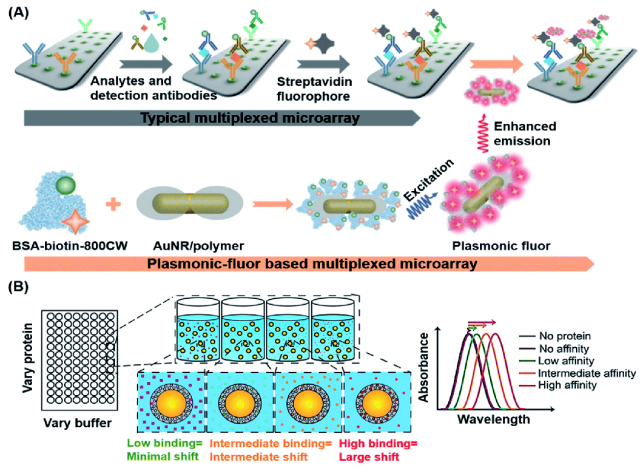
图8 (A) 等离子体-荧光基团结构及其作为生物标记物的工作原理示意图,以提高免疫测定的 FL 和 S/N 比。等离子体荧光团由等离子体活性核心 (AuNR)、作为间隔层的聚合物壳、光发射器和作为通用生物识别元件的生物素组成。在检测过程中,分析物被微阵列和样品混合物中的检测抗体识别,产生夹心结构,然后与链霉亲和素和等离子体荧光团结合,实现增强光信号检测。转载自参考文献。142经许可。版权所有 2020 Springer Nature。(B) 基于LSPR的生物传感器的示意图,用于基于不同亲和力相互作用的泪液生物标志物的无标记检测。基于折射率变化对蛋白质结合量的依赖性至关重要的传感策略,对于低亲和力接触或低蛋白质浓度,预计 LSPR 波长几乎没有变化。随着蛋白质浓度或亲和力的增加,预计LSPR波长的红移会更大。转载自参考文献。143经许可。版权所有 2018 美国化学学会。
除了使用SPR进行荧光增强外,贵金属纳米材料的局部SPR(LSPR)也可用于影响折射率的变化,使LSPR成为POC诊断的有效转导策略。基于这一特性,Peppas的团队开发了一种无标记方法,通过使用涂有聚(N-异丙基丙烯酰胺-共甲基丙烯酸)纳米凝胶(AuNS@PNM)的二氧化硅金纳米壳来检测人体眼泪中存在的生物标志物,该纳米凝胶作为相应的蛋白质受体。143如图8B所示,在具有不同电荷的不同蛋白质(包括溶菌酶和乳铁蛋白,它们是慢性干眼症的已知生物标志物)结合时,检测到AuNS@PNM折射率的不同变化,并且由此产生的生物传感器在LSPR波长中显示出较大的、与浓度相关的红移,并且很容易用便携式光谱仪测量。
基于发光和比色法的光学POC传感器
发光,包括荧光、化学发光和电致发光,已成为一种有吸引力的方法,也是一种潜在的有用替代方法,用于疾病检测和诊断,这主要是由于其快速、非侵入性、实时、低成本和高分辨率的特性。34,144,145在与感兴趣的生物分析物直接或间接相互作用时,识别系统的光物理特性将呈现出可以通过使用光谱仪或肉眼轻松检测到的信号。146在各种基于发光的方法中,基于荧光共振能量转移 (FRET) 的传感系统已被广泛用于基于荧光的 POC 测试。108尽管前面描述的一些基于CRISPR和SERS的POC方法也使用荧光作为信号换能器,但由于荧光和化学发光领域仍有许多新兴的POC方法,因此本节单独列出是为了更好地组织和更方便的解释。
Lu等人报道了一种简单的“锁钥匙”策略,使用咪唑鎓功能化聚二乙炔(iPDA)快速、特异性地鉴定溶血磷脂酸(LPA)用于卵巢癌的早期诊断。147基于LPA和iPDAs之间的协同静电和疏水相互作用,LPA“钥匙”能够特异性地插入iPDAs“锁”中,导致iPDA的构象转变,并在5分钟内发生蓝色到红色的变化。这种方法被整合到侧向层析试纸中,以100%的准确率成功地将卵巢癌患者的血液与健康人的血液样本区分开来。虽然其他荧光生物传感器可能需要稍长的周转时间,但荧光传感器的总检测时间符合 ASSURED 标准。因此,大多数基于发光的光学POC传感器都专注于提高其灵敏度。
2018 年,Walt 的团队开创了基于飞升阵列中荧光酶促反应的单分子免疫测定 (Simoa),随后由 Quanterix 商业化。148虽然 Simoa 是目前超灵敏检测蛋白质的黄金标准,但其灵敏度受到采样效率低的阻碍。为了解决这一局限性,同一小组最近开发了一种显着简化且更灵敏的数字ELISA平台,称为滴注单分子测定(dSimoa),通过将珠滴投射到载玻片上,然后风干以形成单层薄膜,其信号可以用数字信号读出设备读取(图9A)。149与原来的 Smoa 相比,该平台通过定位携带目标分子的磁珠,无需将磁珠加载到微孔或液滴中进行信号区隔,从而可以分析更多的磁珠,从而将检测灵敏度提高 25 倍。
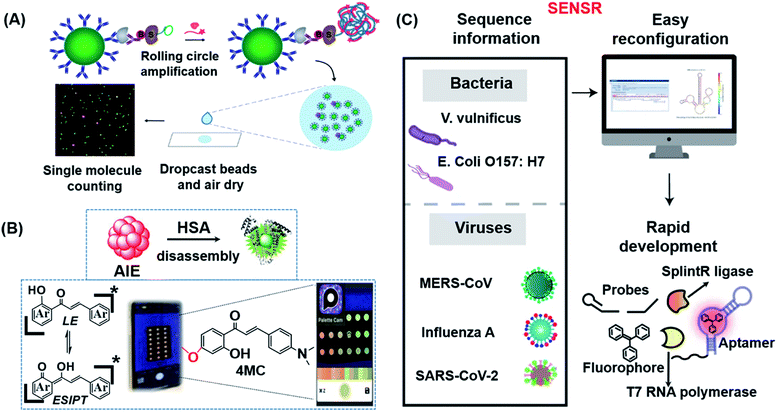
图9 (A) dSimoa的示意图。从左到右,主要结构由抗体包被的顺磁珠、靶蛋白、生物素化检测抗体、标记的链霉亲和素-DNA偶联物、DNA聚合酶和探针组成。在抗体-磁珠-链霉亲和素-DNA夹心上形成单个免疫复合物后,对磁珠进行RCA,以构建连接到每个免疫复合物的长连接体。然后将浓缩的磁珠滴注到显微镜载玻片上,并使用液滴胶片的荧光成像来计数单个目标分子。转载自参考文献。149经许可。版权所有 2020 美国化学学会。(B)纸基比例荧光分析装置的设计原理图和4MC的化学结构。在该测定中,通过比较探针在聚集态和单体态下的发射比来确定 HSA 的浓度,这导致在通过将识别探针集成到检测板中而开发的简单便携式纸基分析设备上出现可见的红色到绿色变化。转载自参考文献。150经许可。版权所有 2020 Wiley-VCH。(C) 说明SENSR的广泛适应性及其对各种病原体的易重构和快速发展。该测定依赖于持续的等温反应级联反应,产生与荧光染料结合的 RNA 适配体。T7 RNA 聚合酶从启动子 DNA 探针和报告基因 DNA 探针转录 RNA 适配体,这些探针通过 SplintR 连接酶与靶单链 RNA 序列杂交。一锅等温反应后,复合物在反应管中显示出强烈的荧光。通过重新设计探针序列来靶向2种病原微生物和3种病毒。转载自参考文献。151经许可。版权所有 2020 Springer Nature。
在荧光生物传感器领域开发的大多数探针都是可激活的探针(即关闭型),它们具有响应某些刺激而“打开”的独特特性,具有与分析物浓度成正比的可测量荧光信号。尽管许多可激活探针已显示出作为生物传感探针的巨大潜力,但荧光分子的光源衰减和光漂白是容易使检测结果不准确的常见因素。为了克服这些局限性,Liu的团队成功开发了一种基于聚集诱导发射(AIE)的双态发射查耳酮探针(4MC),用于老年和慢性不适患者人血清白蛋白(HSA)的POC监测(图9B)。150HSA的浓度是通过HSA诱导的特异性HSA诱导的4MC纳米聚集体分解成4MC-HSA复合物来确定的,这导致了明显的比例发射颜色变化(从红色到绿色;图9B)。随后,探针4MC被集成到纸质分析设备中,用于肉眼检测全血中的HSA。
对于大多数体外POC传感器来说,LoD不足仍然是最令人担忧的问题。Lee的团队开发了一种名为SENSR的一锅和连接依赖性等温反应级联反应,可用于快速灵敏地检测RNA(图9C)。151报道的 SENSR 由两个简单的酶促反应组成:SplintR 连接酶的连接反应,然后是 T7 RNA 聚合酶的转录。所得转录本形成与荧光染料结合的RNA适配体,产生平面RNA稳定的荧光染料结构,该结构仅在检测到测试样品中存在的RNA靶标时发出荧光。该方法的一个重要特征是LoD可低至0.1 aM(100 μL反应中∼6个RNA拷贝)。如图9C所示,该策略可以很容易地重新配置,以检测临床样本中的各种病原体。
与其他基于发光的方法相比,化学发光具有更高的灵敏度和更好的信噪比。此外,化学发光读数仪器比其他光学仪器更简单,使其更有可能用于 POC 检测。109基于化学发光的潜在 POC 系统简化了读数,提高了灵敏度,并使传感器独立于外部光源。152Johnsson的团队通过抗体片段与NanoLuc荧光素酶和SNAP标签的基因融合,设计了半合成的生物发光传感器蛋白。药物的结合取代了系留荧光竞争物,并破坏了比率传感器中的生物发光共振能量转移 (BRET)。颜色以药物浓度依赖性方式从红色变为蓝色,这允许使用数码相机直接进行 POC 定量。153受这项工作的启发,他们报告了一种半合成生物发光传感器,用于使用纸质测定直接定量磷酸化烟酰胺腺嘌呤二核苷酸(NADPH)。154如图10A所示,生物传感器由NanoLuc荧光素酶标记的NADPH传感器蛋白和用竞争性荧光系绳合成标记的SNAP标签组成。在NADPH存在下,荧光系绳与受体蛋白结合并产生BRET,从而改变颜色(从蓝色到红色),并通过使用数码相机实现直接NADPH定量。这种方法原则上允许将任何被NADPH氧化的代谢物用于定量POC测定。作为概念验证,作者证明,只需一次相机拍摄即可成功定量96个苯丙氨酸加标血液样本。最近,还开发了一种类似的生物传感器用于NAD检测。+155
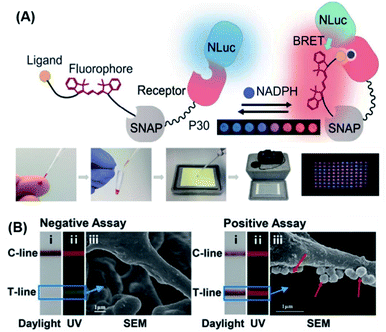
图 10 (A) 用于NADPH的POC测试的BRET传感器的设计原理以及使用肉眼对96个苯丙氨酸样品进行平行分析的结果。对于这种方法,代谢物被烟酰胺腺嘌呤二核苷酸磷酸氧化,当存在还原辅因子时,传感器会改变颜色,从而允许使用数码相机测量代谢物。转载自参考文献。154经许可。版权所有 2018 美国科学促进会。(B) 在日光 (i)、紫外线 (ii) 和 SEM 图像 (iii) 下用急性心肌梗死阴性和阳性测定法治疗后的比率荧光侧流免疫测定 (RFLFIA) 条带 (50 ng mL−1).在该设计中,RFLFIA条根据荧光信号的比例变化工作,这是由于两个复合纳米结构共轭以捕获和探测抗体而发出的荧光的混合以及金纳米颗粒的内部过滤效应引起的。最后,通过使用基于智能手机的定制分析设备实现检测。转载自参考文献。159经许可。版权所有 2021 Wiley-VCH。
便携式侧向层析免疫测定 (LFIA) 试纸广泛用于 POC 测试。它们价格低廉、快速(10-20 分钟)、对目标分析物的检测具有选择性,并且可以在各种信号读出设备中用肉眼读取。156,157尽管有许多可用的LFIA方法,但由于光漂白、光散射、激发光波动等与分析物无关的参数,它们中的大多数都无法定性地区分具有弱色测试线的低浓度目标。 比率荧光技术被认为是一种解决方案,因为它依赖于两个或多个发射带的强度之比。158在此基础上,Wang等人开发了一种新型的基于比率荧光的LFIA(RFLFIA)条带,用于使用智能手机裸眼检测心脏型脂肪酸结合蛋白(H-FABP)。159RFLFIA条带由合适的报告基因和捕获探针构建,该探针由两种量子点与两种不同类型的H-FABP抗体偶联而成。RFLFIA的传感机制涉及两个量子点之间的靶诱导内滤光效应,最终导致荧光颜色变化(从绿色到红色),并伴随着条带膜形态(SEM图像)的变化(图10B)。
上述方法大大提高了多重检测的检测精度和能力。然而,由于荧光分子的光学漂白和化学制备路线的复杂性,仍有一些重要问题需要解决,包括荧光分子的稳定保存、所采用的化学方法的进一步简化等,以实现实用和稳健的POC应用。
近年来,旨在最终实现POC检测的新策略已经成功开发,以检测从核酸到人类癌细胞的各种生物分子。随着对人类各种疾病的了解不断加深,以及不同科学领域(化学、生命科学、材料等)的不断进步,前沿研究现在不仅关注检测目标生物分析物的方法开发,更重要的是设计可用于检测含有多种生物分子的一类靶标的多功能方法。这些生物传感器策略的发展促进了对真实临床样本靶标的定量分析,并有力地推动了新兴医疗行业更多地参与临床POC系统的进一步开发。在这篇小型综述中,我们讨论了基于不同设计原则的 POC 检测/诊断系统的最新工作,包括 CRISPR,它真正代表了生物技术、电化学和光学的最新进展。可检测的靶分子范围从核酸(包括 DNA、RNA 和 microRNA)到蛋白质、小分子、细菌和人体细胞。我们还详细描述了传感、探头、换能器等方面的各种设备配置,这些配置可以作为相关领域感兴趣的研究人员的重要参考。
国际医疗器械展览会Medtec相信未来的POC系统将能够使用单个芯片实现不同生物分子的多路复用传感甚至高通量筛选,并根据高度可靠且易于区分的读出信号同时诊断不同的人类疾病,从而使POC传感器真正具有时间效率、成本效益、快速响应和易于部署在资源匮乏地区。例如,电化学探针可以设计为在单个芯片上包含多个信号探针,但具有不同的活化电位,以便可以测量不同目标的浓度。此外,POC系统的精度不仅可以通过集中目标,还可以增强传感信号或减少背景信号来提高。受PCR的启发,扩增策略可应用于除核酸以外的其他生物分子。此外,不同技术的融合可能会产生新的和更有效的方法,正如基于CRISPR的方法与电化学、PC和SPR相结合的众多发展所成功证明的那样。在未来几年,我们可能还会期待一些创新的机器学习研究,通过使用基于人工智能(AI)的技术进行POC检测。最终,所有这些技术都有望集成到具有实时监控功能的可穿戴设备中。我们认为,只要解决量产问题,POC系统的发展就会有光明的未来。
原文链接:https://pubs.rsc.org/en/content/articlelanding/2022/SC/D1SC06269G
文章来源:Chemical Science











