国际医疗器械展览会Medtec解读光学新技术:胃肠内窥镜研究进展(技术综述)
2024-09-18
关键词:胃肠道,机器学习,分子探针,光学内窥镜
我们对用于胃肠道癌症筛查和监测的光学内窥镜成像技术进行了技术回顾。国际医疗器械展览会Medtec小编转载的本文总结了光-组织相互作用的原理、不同尺度下的成像性能,并重点介绍了临床适用性和有效性。此外,我们还讨论了新型分子探针的翻译和基于人工智能的算法的集成,以提供决策支持。
光学内窥镜检查是治疗胃肠道 (GI) 恶性肿瘤的主要诊断和治疗工具。大多数胃肠道肿瘤起源于癌前病变;因此,改善癌前病变和早期癌症检测和诊断的技术创新在改善结果方面发挥着关键作用。在过去的几十年里,胃肠道内窥镜检查领域见证了巨大而集中的努力,以开发和转化准确、用户友好和微创的光学成像方式。从技术角度来看,现在有各种各样的新型光学技术可用于在宏观和微观尺度上探测光-组织相互作用的不同方面,补充白光内窥镜检查。这些新模式中的大多数已成功验证并转化为常规临床实践。在此,我们对用于胃肠道癌症筛查和监测的现有和有前途的新型光学内窥镜成像技术的现状进行了技术综述。我们总结了光-组织相互作用的基本原理、不同尺度下的成像性能,并强调了对临床适用性和有效性的了解。此外,我们讨论了最近发现和翻译的新型分子探针,这些探针有望增强内窥镜医师诊断高特异性胃肠道病变的能力。我们还回顾和讨论了基于人工智能的算法在实时提供决策支持方面的作用和潜在的临床整合。最后,我们提供了对未来技术发展及其改变内窥镜胃肠道癌症检测和诊断的潜力的看法。
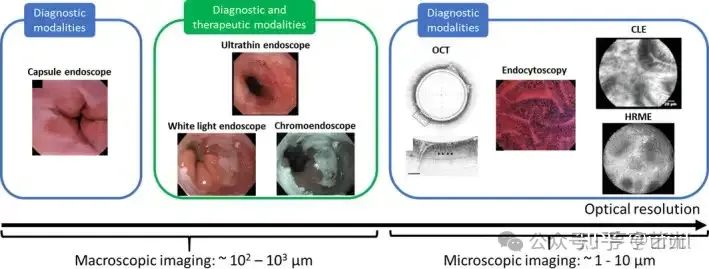
图1
用于胃肠道粘膜宏观和微观成像的光学内窥镜技术。现有的宏观方式包括高清内窥镜、超薄内窥镜和胶囊内镜。使用 OCT、内吞细胞镜检查、CLE 和 HRME 可实现显微分辨率。经爱思唯尔许可转载自[66, 81, 136](分别为白光和色素内窥镜、胶囊内窥镜和内吞吞镜),经John Wiley and Sons许可转载自[55](超薄内窥镜),经施普林格·自然(OCT)许可转载自[137],经Georg Thieme Verlag KG(CLE)许可©转载自[69]。
总之,这种广泛的技术在图中。1为内窥镜医师提供了强大的工具,从宏观和显微镜下检查胃肠道,为下一代胃肠道内窥镜检查奠定了基础。如表中总结1,为了帮助指导有前途的新技术的转化,美国胃肠道内镜学会(American Society for GI Endoscopy, ASGE)创建了有价值的内窥镜创新(endoscopic innovations, PIVI)性能阈值,用于评估巴雷特食管和结直肠息肉的新技术在采用前应满足这些阈值[23,24
表1 采用新成像技术进行胃肠道病变评估的PIVI性能阈值[23,24]。
| 临床状况 | 影像学引导下内镜治疗 | 所需的性能阈值 |
|---|---|---|
| 巴雷特食管 | 进行靶向活检(无随机活检) | 用于诊断HGD和EAC敏感性> 90%,特异性> 80%阴性预测值 (NPV) > 98% |
| 直肠乙状结肠息肉 | 留下 5 毫米或更小的疑似增生性息肉而不切除 | 用于腺瘤组织学的诊断NPV > 90%,使用时置信度高 |
| 结直肠息肉 | 切除并丢弃 5 毫米或更小的息肉,无需组织病理学评估 | 用于确定息肉切除术后监测间隔> 90% 与组织病理学的一致性,当以高置信度使用并结合组织病理学评估 息肉时>5 mm |
| 临床状况 | 影像学引导下内镜治疗 | 所需的性能阈值 |
|---|---|---|
| 巴雷特食管 | 进行靶向活检(无随机活检) | 用于诊断HGD和EAC敏感性> 90%,特异性> 80%阴性预测值 (NPV) > 98% |
| 直肠乙状结肠息肉 | 留下 5 毫米或更小的疑似增生性息肉而不切除 | 用于腺瘤组织学的诊断NPV > 90%,使用时置信度高 |
| 结直肠息肉 | 切除并丢弃 5 毫米或更小的息肉,无需组织病理学评估 | 用于确定息肉切除术后监测间隔> 90% 与组织病理学的一致性,当以高置信度使用并结合组织病理学评估 息肉时>5 mm |
| 临床状况 | 影像学引导下内镜治疗 | 所需的性能阈值 |
|---|---|---|
| 巴雷特食管 | 进行靶向活检(无随机活检) | 用于诊断HGD和EAC敏感性> 90%,特异性> 80%阴性预测值 (NPV) > 98% |
| 直肠乙状结肠息肉 | 留下 5 毫米或更小的疑似增生性息肉而不切除 | 用于腺瘤组织学的诊断NPV > 90%,使用时置信度高 |
| 结直肠息肉 | 切除并丢弃 5 毫米或更小的息肉,无需组织病理学评估 | 用于确定息肉切除术后监测间隔> 90% 与组织病理学的一致性,当以高置信度使用并结合组织病理学评估 息肉时>5 mm |
| 临床状况 | 影像学引导下内镜治疗 | 所需的性能阈值 |
|---|---|---|
| 巴雷特食管 | 进行靶向活检(无随机活检) | 用于诊断HGD和EAC敏感性> 90%,特异性> 80%阴性预测值 (NPV) > 98% |
| 直肠乙状结肠息肉 | 留下 5 毫米或更小的疑似增生性息肉而不切除 | 用于腺瘤组织学的诊断NPV > 90%,使用时置信度高 |
| 结直肠息肉 | 切除并丢弃 5 毫米或更小的息肉,无需组织病理学评估 | 用于确定息肉切除术后监测间隔> 90% 与组织病理学的一致性,当以高置信度使用并结合组织病理学评估 息肉时>5 mm |
| 临床状况 | 影像学引导下内镜治疗 | 所需的性能阈值 |
|---|---|---|
| 巴雷特食管 | 进行靶向活检(无随机活检) | 用于诊断HGD和EAC敏感性> 90%,特异性> 80%阴性预测值 (NPV) > 98% |
| 直肠乙状结肠息肉 | 留下 5 毫米或更小的疑似增生性息肉而不切除 | 用于腺瘤组织学的诊断NPV > 90%,使用时置信度高 |
| 结直肠息肉 | 切除并丢弃 5 毫米或更小的息肉,无需组织病理学评估 | 用于确定息肉切除术后监测间隔> 90% 与组织病理学的一致性,当以高置信度使用并结合组织病理学评估 息肉时>5 mm |
| 临床状况 | 影像学引导下内镜治疗 | 所需的性能阈值 |
|---|---|---|
| 巴雷特食管 | 进行靶向活检(无随机活检) | 用于诊断HGD和EAC敏感性> 90%,特异性> 80%阴性预测值 (NPV) > 98% |
| 直肠乙状结肠息肉 | 留下 5 毫米或更小的疑似增生性息肉而不切除 | 用于腺瘤组织学的诊断NPV > 90%,使用时置信度高 |
| 结直肠息肉 | 切除并丢弃 5 毫米或更小的息肉,无需组织病理学评估 | 用于确定息肉切除术后监测间隔> 90% 与组织病理学的一致性,当以高置信度使用并结合组织病理学评估 息肉时>5 mm |
| 临床状况 | 影像学引导下内镜治疗 | 所需的性能阈值 |
|---|---|---|
| 巴雷特食管 | 进行靶向活检(无随机活检) | 用于诊断HGD和EAC敏感性> 90%,特异性> 80%阴性预测值 (NPV) > 98% |
| 直肠乙状结肠息肉 | 留下 5 毫米或更小的疑似增生性息肉而不切除 | 用于腺瘤组织学的诊断NPV > 90%,使用时置信度高 |
| 结直肠息肉 | 切除并丢弃 5 毫米或更小的息肉,无需组织病理学评估 | 用于确定息肉切除术后监测间隔> 90% 与组织病理学的一致性,当以高置信度使用并结合组织病理学评估 息肉时>5 mm |
在这篇技术综述中,我们概述了胃肠道内窥镜检查的现有和新兴光学成像方式的现状。ASGE技术委员会、欧洲胃肠道内镜学会(European Society of GI Endoscopy, ESGE)研究委员会和其他作者对胃肠道内镜成像技术的既往综述[18,24,25,26],重点关注市售和常用研究模式(如CE和CLE)的性能,同时详细描述了其临床表现的现有证据。在这篇综述中,我们重点介绍了光学内窥镜的技术方面和临床适用性,重点介绍了设备和光学设计、分子探针和用于图像解释的机器学习算法的最新进展。除了商用平台外,我们还讨论了临床转化早期阶段的新兴技术,总结了它们如何利用光-组织相互作用的不同维度来识别胃肠道癌症进展早期阶段的病变。对于每种模式,我们讨论了成像能力,同时强调了光-组织相互作用的基本原理及其对临床实用性的影响。我们回顾了具有各种新颖外形尺寸的成像系统(图中的示例)。2),包括胶囊、球囊导管和探针,并讨论它们如何通过增强对比度和分辨率促进胃肠道的多模态和微创成像。我们还回顾了新型分子探针和机器学习算法的临床转化和整合。
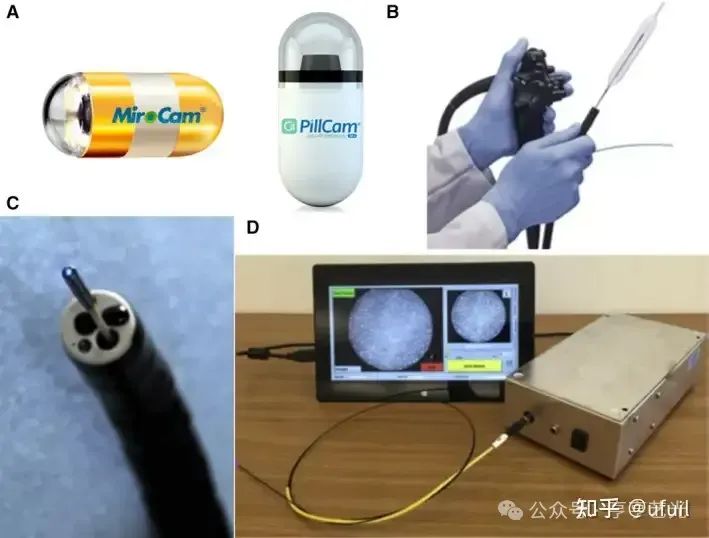
图2
基于胶囊、球囊和探头的光学内窥镜系统示例。(A) 胶囊内窥镜(MicroCam 和 PillCam)。(B) 充气球囊导管内的 VLE 探头。(C) 通过活检通道的共聚焦激光内窥镜。(D) 带有集成诊断软件的低成本 HRME。图2B–D转载自[97, 138, 139],经Elsevier.许可。
2. 宏观成像系统
2.1. 当前护理标准:白光内窥镜检查、
由于胃肠道独特的解剖结构,使用白光照明的传统内窥镜检查仍然是评估胃肠道病变的金标准。尽管WLE已常规使用,但迫切需要进一步提高WLE的诊断性能。例如,对于Barrett食管的监测,四象限随机活检取样(称为Seattle方案)仍然是当前指南中重要且必不可少的组成部分[29]。同样,在许多亚洲国家,使用 Lugol 染色的 CE 通常用于 ESCC 筛查。在筛查结肠镜检查时,ESGE也推荐使用高清内镜检查和虚拟CE等先进模式[18]。
在过去的几十年里,WLE的技术性能得益于成像传感器和光学器件的改进,这些传感器和光学器件提供了更高的像素密度和更高的放大倍率。自 1990 年代后期以来,高清内窥镜已广泛使用,能够更细致地检查粘膜模式,并取代标清内窥镜成为当前的首选方式。标准高清内窥镜进一步辅以微创超薄内窥镜和胶囊内窥镜,详细成像特征和规格对比见表2.最近的商业系统还增加了先进的成像功能,包括具有高达 150 倍光学放大倍率的放大内窥镜和各种增强粘膜特征的技术,例如 CE。虽然将高清内窥镜与标清 WLE 进行比较的数据相对较少,但高清内窥镜已用于许多临床研究,尤其是与虚拟或基于染料的 CE 结合使用。
表2 用于胃肠道粘膜宏观成像的市售内窥镜系统[140,141,142]。
| 内窥镜系统 | 高清内窥镜 | 超薄内窥镜 | 胶囊内窥镜 |
|---|---|---|---|
| 内窥镜直径(约) | 9–13 毫米 | 5–6 毫米 | 11 毫米 |
| 视场角 | 140° 至 170° | 120° 至 140° | 145° 至 170° |
| 相机分辨率 | 高清晰度(高达 200 万像素) | 标准定义(100 000–400 000 像素) | 256 × 256 到 512 × 512 像素 |
| 范围指导 | 4 向角度 | 2 向或 4 向角度 | 被动蠕动;外部磁力转向 |
| 先进的成像能力 | 是的 | 是的 | 不 |
| 镇静要求 | 是的 | 不 | 不 |
| 胃肠道可达性 | 上消化道或下消化道 | 上消化道 | 上消化道或下消化道,包括小肠 |
| 活检能力 | 是的 | 除一次性版本外,大多数型号均受支持 | 不 |
在未来高清WLE的发展将受益于光学FOV和分辨率以及3D成像能力的进一步改进。如表所示2,目前的高清内窥镜可以支持高达2K的视频采集,角视场角为140-170°。为了更好地研究胃肠道解剖结构,人们正在开发宽视场内窥镜,以提供超宽角度或近全景视野(245-330°),初步研究表明,它们有助于更好地检测结肠息肉,并改善上消化道隐匿区域的可视化[30,31,32,33]。 此外,具有UHD分辨率(4k或8k与当前2k相比)和3D成像能力的内窥镜,虽然主要在腹腔镜应用或动物模型中得到证明[34,35,36],但也有可能实现更详细的粘膜检查,并增强胃肠道的手术可操作性。
2.2. 虚拟色素内窥镜检查
与基于整个可见光谱的 WLE 相比,虚拟 CE 利用光与组织相互作用的光谱变化来突出粘膜特征,例如血管或光散射的变化。由于光谱成像可以通过光学滤波或后处理来实现,而无需修改成像光学元件,因此虚拟 CE 可以无缝集成到当前大多数内窥镜系统中。只需按一下按钮,它就为内窥镜医师提供了一种方便的方法,可以增强对比度来研究病变。第一代虚拟 CE 包括窄带成像 (NBI;奥林巴斯,东京,日本)、富士智能色度内窥镜(FICE;Fujinon,日本东京)和iScan(宾得,日本东京)。最近还引入了较新的模式,例如蓝色激光成像。如表中总结3,NBI通过用蓝光(415nm)和绿光(540nm)照亮胃肠道表面来增强粘膜特征和微血管网络的对比度;相比之下,FICE 和 iScan 基于后处理算法来改善血管可视化和组织类型区分。在这些模式中,NBI 是最常研究的虚拟 CE 模式;由于其广泛可用,以及具有实质性观察者间一致性的既定解释标准[37],该模式被广泛接受,尤其是在专家中。
表3 商业内窥镜平台提供先进的成像模式。
| 影像学检查方式 | 虚拟 CE | 染料基 CE | |||||
|---|---|---|---|---|---|---|---|
| NBI(英语:NBI) | FICE | iScan的 | 靛蓝胭脂红 | 亚甲蓝 | 醋酸 | 卢戈氏碘 | |
| 对比度的来源 | 反射系数;血红蛋白吸收 | 反射系数 | 反射系数 | 外源染料的反射率 | 被小肠和结肠上皮吸收 | 醋酸美白 | 被高糖原组织吸收 |
| 靶向临床特征 | 黏膜模式和血管网络 | 黏膜模式和血管网络 | 黏膜模式和血管网络 | 黏膜拓扑结构,如凹坑和脊 | 肠上皮细胞摄取 | 黏膜模式 | 正常鳞状上皮细胞的摄取 |
在一项meta分析纳入了14项研究,涉及843例患者,结果显示,在Barrett食管中,CE可将异型增生/癌症检测的诊断率提高34%[38]。作为一种被广泛研究的方式,NBI被证明符合BE监测的PIVI阈值(表1),推荐与标准WLE联合使用[25,29]。 对于胃癌前病变组织学检查,ESGE推荐NBI,因为与单独使用高清内镜检查相比,NBI能够显著改善肠上皮化生的检测[15]。在筛查结肠镜检查方面,ASGE的一项meta分析报道,在学术中心使用NBI检测腺瘤的NPV为91%,超过了90%的PIVI阈值,支持对小息肉的“诊断和离开”策略[24]。然而,应该注意的是,在社区环境中报告了不符合相同标准的低于标准的结果[39,40]。 根据ESGE的建议,只有当内镜检查得到充分记录并由专家进行时,才建议使用虚拟CE进行光学诊断[18]。
在有最新平台的环境中,虚拟 CE 已显示出在不产生额外成本和应用外源性染料的情况下更好地可视化胃肠道病变的巨大前景。由于如今大多数高清内窥镜系统都提供 CE 兼容性,因此它正在获得动力和越来越受欢迎,尤其是在专家中。然而,为了支持它们的常规使用,需要建立通用分类标准并进行外部验证,特别是在研究中心以外的新手用户中。此外,还需要研究相关的学习曲线和观察者间可靠性。同时,应认识到技术进步的重要性。最近一篇meta分析纳入了11项随机对照试验(randomized controlled trials, RCT),结果显示,与WLE和第一代NBI相比,第二代更明亮的NBI显著提高了腺瘤检出率(adenoma detection rate, ADR)[41]。
作为利用特定光谱波段组织反应的市售虚拟CE的扩展,多光谱或高光谱成像也显示出具有增加光谱维度的胃肠道病变表征的价值[42,43]。 最近,实时高光谱成像已在内镜系统中实现,并报道了胃肠道的初步临床评估[44,45,46]。 综上所述,随着技术的不断改进和临床使用的标准化,预计虚拟 CE 将进一步改善胃肠道病变检测。
2.3. 基于染料的色素内窥镜检查
与虚拟 CE 中的光学或计算过滤不同,基于染料的 CE 利用外源染料来增强粘膜特征的对比度,尤其是在 WLE 下可能看起来微妙、扁平或凹陷的病变中。一般来说,临床上使用两种类型的染料:吸收性染料,如亚甲蓝和卢戈氏碘,以及造影剂染色剂,如靛蓝胭脂红(表3).在这些染料中,Lugol 的碘选择性地与糖原结合,糖原比发育不良的鳞状上皮细胞更丰富地储存在正常人中。亚甲蓝优先被小肠或结肠类型的上皮细胞吸收,靛蓝胭脂红通过填充缝隙、凹坑和脊来突出粘膜拓扑结构。
国际医疗器械展览会Medtec将在现场同期举办技术论坛E:医疗器械诞生的助推器——创新医用材料/配件及精加工论坛,本次会议将结合生物医用材料、精密配件及生产中精密的加工工艺在医疗器械中的应用为器械生产商和供应商提供交流平台。现在预登记参观参会限时免费>>>
成像造影剂的来源,以及目标粘膜特征,取决于特定染料的染色或摄取机制。由于其被糖原丰度细胞的高摄取率,Lugol碘通常被用作一种高灵敏度(92-100%灵敏度)但价格低廉的染料,用于ESCC筛查[2]。对于巴雷特食管的监测,系统评价显示使用醋酸或亚甲蓝可提高诊断率和准确性;因此,除WLE外,还推荐将CE作为辅助工具[29]。对于染料的选择,乙酸价格低廉,符合BE监测的ASGE阈值(表1),早期证据表明,在高危人群中,它比随机活检更具成本效益[29,47]。亚甲蓝也可显著增强对比度,但由于其与DNA损伤有关,因此引起了人们的担忧[48]。在胃方面,一篇meta分析纳入了10项使用不同染料的研究,结果显示,与WLE相比,基于染料的CE能更好地检测早期胃癌和前体癌(699例患者的合并敏感性和特异性分别为0.90和0.82)[49]。
在无法使用具有虚拟 CE 的最新内窥镜平台的环境中,基于染料的 CE 提供了一种安全且相对便宜的替代方案来增强粘膜对比度,尽管它需要更繁琐的程序并依赖于喷涂的质量和均匀性。与虚拟 CE 一样,要充分利用基于染料的 CE,用户专业知识至关重要。此外,尚未就经过验证的解释标准达成共识,鉴于染料种类繁多及其不同的摄取或染色模式,这可能特别具有挑战性。
2.4. 超薄内窥镜
与标准内窥镜相比,超薄内窥镜设计用于进入较小的管腔器官,因此可以在无镇静的门诊手术中进行内窥镜检查,即使图像解读仍然需要专业知识。由于直径较小(6mm或更小,而标准内镜为13mm),患者的接受度更高,并发症风险和恢复时间更低[50]。权衡包括降低像素分辨率和降低机械可操作性(表2);小儿活检钳可以通过辅助通道进行活检,但执行更复杂外科手术的能力有限。为了进一步促进该技术的临床应用,还开发了成本更低、便携和一次性的超薄内窥镜,但不支持活检功能[51]。
几项初步研究报道了超薄内窥镜检查上消化道病变的能力。作为一种成本较低的门诊手术,使用超薄内窥镜的经鼻内镜被认为是BE筛查的潜在替代方案[7],尽管其在BE监测中的作用受到相对较低的成像质量的限制。一项纳入82例患者的随机交叉试验研究发现,经鼻内镜检查在BE检测方面具有较高的诊断性能(敏感性为98%,特异性为100%),与标准WLE相当[52];尽管如此,由于在三级医疗中心检查了丰富的监测人群,因此需要进一步研究这项研究的普遍性。57例浅表性胃肿瘤患者或ESD后接受随访内镜检查的患者也评估了超薄内镜检查对胃肿瘤的检测效果,报告的性能特征明显低于高清WLE[53]。这可以归因于示波器操作的难度增加和成像质量相对较差。由于最新的超薄模型具有更好的照明和NBI能力[54,55],因此应进一步评估其在上消化道中的潜在作用。
2.5. 胶囊内窥镜检查
胶囊内窥镜检查于 2001 年首次获得 FDA 批准,可轻松安全地进入胃肠道(图 1)。2安培).在过去的二十年中,胶囊内镜彻底改变了小肠疾病的治疗[56]。大多数市售的胶囊内窥镜由微型成像传感器、照明和成像光学元件以及封装在一次性外壳中的内部电源组成。数据传输通常通过无线电遥测或电场传播以无线方式实现[57],有线数据检索也有报道在系留胶囊中[58]。市售胶囊内窥镜检查的典型成像规格见表2.
鉴于胶囊内窥镜在小肠中的成功应用,人们越来越有兴趣研究其在胃肠道其他部位的作用。在上消化道,由于独特的解剖结构,胶囊内窥镜检查具有挑战性。胶囊通过食管的平均传输时间可低至约30 s[59],因此需要快速帧速率才能捕获高质量图像;一旦进入胃部,不受控制的胶囊运动会使图像采集进一步复杂化。使用每秒捕获 35 帧的 Pillcam UGI 胶囊,胶囊内窥镜检查已被证明可以可视化食管的重要临床标志;此外,在护士主导的方案中,将患者置于不同平面和角度的检查床上,证明了观察整个胃的可行性[59]。然而,由于其中等准确性(Bhardwaj等人对9项研究(涉及618例患者的meta分析)对BE检测的敏感性为78%,特异性为73%),因此不推荐将其用于BE筛查[7,60]。在下消化道,胶囊内镜检查也有助于发现结肠镜检查不完全患者的其他息肉[61]。
胶囊内窥镜检查的一个主要缺点是缺乏主动运动,这会影响其成像质量并限制其在管腔器官中的使用。最近,人们通过内部稳定或外部控制机制克服了这一障碍[62,63]。 结合体外磁力转向系统,胶囊内镜检查已被用于检查胃肠道中更宽敞的部位[64]。最近的一项研究报告称,在3182例无症状受试者中,该药可安全用于观察胃部局灶性病变,表明其具有筛查胃癌的潜力[65]。虽然处于开发的早期阶段,但使用更新的磁控胶囊系统的最新临床证据显示成像质量和可操作性有所改善[66,67],未来有必要进行研究以评估其诊断价值。
3. 显微成像系统
虽然宏观成像方式构成了胃肠道内窥镜检查的基础,但癌症诊断的金标准仍然是显微镜检查。在常规实践中,这是通过采集活检和标准组织学程序来实现的。这个过程可能导致不必要的活检和相关的医疗费用、诊断延误和失访。因此,长期以来,人们一直对开发体内内窥镜技术感兴趣,以促进具有微观或近显微分辨率的病变表征。在本节中,我们将回顾内窥镜成像技术(表4),包括商用系统,如CLE和容积式激光内窥镜(VLE),以及研究性研究系统,如高分辨率显微内窥镜(HRME)和基于光学相干断层扫描(OCT)的胶囊。
表4 胃肠道中使用的显微成像技术[97,138,139,143,144]。
| 影像学检查方式 | CLE的 | 内吞作用 | 10月 | 人力资源部 |
|---|---|---|---|---|
| 内窥镜外形尺寸 | 基于内窥镜或探头 | 基于内窥镜或探头 | 基于探针、胶囊或球囊 | 基于探头 |
| 对比度的来源 | 荧光 | 反射系数 | 反射系数 | 荧光 |
| 造影剂 | 荧光 素 | 亚甲蓝和结晶紫 | 那 | 黄素 |
| 靶向临床特征 | 细胞外基质 | 细胞结构形态 | 细胞结构形态 | 细胞核 |
| 分辨率 | 1–3.5 微米 | 1.7–4.2 微米 | ~ 10 微米 | 4.4微米 |
| 成像深度 | 高达 70 μm | 表面 | 1–2.5 毫米 | 表面 |
| 视场角 | 200–300 微米 | 120–700 微米 | 带回拉的大视场角 | 790微米 |
| 发展阶段 | 商用;在整个胃肠道中进行了广泛评估 | 商用;在整个胃肠道中进行临床评估 | 商用;主要在食管中评估 | 在食管和结肠中评估 |
| 关于临床适用性的评论 | 与分子探针兼容;成本高 | 与外源染料和高级成像(如NBI)兼容;成本高 | 无标签,允许大面积扫描;与染料或分子探针不相容;成本高 | 可能与分子探针兼容;低成本 |
3.1. 共聚焦激光内窥镜
通过用扫描低功率激光照射染色组织,CLE(图1)。2C的)可以生成具有微米级分辨率的粘膜层荧光图像,提供与标准病理学相似的组织学信息(表4).为了以高对比度对深部上皮层进行成像,实施了共聚焦扫描进行光学切片。可以使用两种类型的荧光造影剂,包括静脉注射的荧光素,以及局部应用的重要染料,如吖啶黄素、四环素或甲酚紫。荧光素增强细胞外基质(如粘膜隐窝和绒毛)以及血管结构的对比度。局部应用染料对细胞核进行染色,从而可视化细胞核形态测量。在临床实践中,荧光素已获得FDA批准,使用最广泛,无不良反应[68],并且已经建立了称为迈阿密分类的共识分类标准[69]。
总体而言,使用CLE检测BE相关异型增生(一项纳入789例患者的meta分析,其合并敏感性和特异性分别为89%和83%)[70]、胃肿瘤(657例患者合并敏感性和特异性分别为81%和98%)[71]和CRC肿瘤(376例患者的合并敏感性和特异性分别为83%和90%)[72].然而,在最近的meta分析中,对体能特征和诊断率的异质性提出了担忧[25,29,70],这表明专业知识的重要性和全面培训的必要性。 虽然在学术研究中心进行的许多研究中提供了良好的诊断性能,但CLE的常规使用在很大程度上受到大量前期投资的阻碍。此外,其小视场对于靶向活检容易出现采样误差,尤其是当由新手用户操作以探测具有稳定视场的小病变时。初步可行性研究证实,在胃肠道中嵌合以成像表面积较大的区域,但临床效用仍然有限[73,74]。 总体而言,与许多其他新兴的微观模式一样,CLE主要在三级中心进行评估。如果没有更好地了解其学习曲线和彻底的成本效用分析,社区使用的实用性仍然未知。
3.2. 内吞作用
内吞作用在原理上类似于放大 WLE,后者提供高达 150 倍光学放大倍率的反射成像,不同之处在于光学放大倍率进一步改进,用于细胞水平成像(表4).市售系统基于内窥镜或基于探头[75],它们支持约500倍(基于内窥镜)至>1000倍(基于探头)的光学放大倍率。为了增强白光照射下的黏膜表面对比度,已发现亚甲蓝或其与结晶紫的组合可用于可视化细胞核和腺体模式[76]。
商业内吞系统已被证明可以对胃肠道病变进行细胞水平表征[77,78,79]。 最近的研究调查了内吞镜检查在处理具有挑战性的任务方面的有效性,例如诊断结肠中的腺瘤性小息肉和低级别腺瘤,报告了较高的诊断性能(39例患者的准确率为96.8%,573例患者的准确率为86.4%)[80,81]。 为了促进其更广泛的应用,人们努力开发标准化临床解释的分类系统[82]。与基于荧光的 CLE 不同,内吞细胞镜检查提供了一种反射模式,以超高分辨率研究可疑病变。除外源性染料外,它还与 NBI 等虚拟 CE 兼容。虽然目前尚无大规模随机对照试验的临床证据,但其进一步评估得到了初步研究的支持,这些研究报告了与CLE相当的性能特征。
3.3. 光学相干断层扫描
OCT使用低相干光源探测不同横向位置的组织反射率,生成深度分辨率的近显微图像,轴向分辨率约为10 μm,横向分辨率约为30 μm(表4).由于 OCT 图像是通过单模光纤获取的,因此它与管腔器官(包括胃肠道和心血管系统)的内窥镜成像本质兼容。为了进入胃肠道病变,已经开发了不同形状的OCT系统,包括可以通过内窥镜工作通道的基于探头和球囊的OCT,以及可在初级保健环境中操作的基于胶囊的设计(表4).使用不同形式的 OCT,已在 Barrett 食管、胃、小肠和结肠息肉中报告了深度分辨和高分辨率成像。
2013 年,一种基于 OCT 的成像系统用于食管成像,称为 VLE(NvisionVLE,NinePoint Medical,Bedford,MA,USA;无花果。2乙).在 VLE 中,球囊导管用于对 OCT 探头进行居中,从而能够在 90 秒内以 3 mm 的成像深度对 6 cm 食管段进行稳定的圆周扫描。自引入以来,已有研究建立图像解译标准,一项纳入27例患者的初步研究显示,BE相关异型增生的诊断准确率为87%[83]。此外,一项多中心随机对照试验正在开发基于人工智能(artificial intelligence, AI)的算法,并正在进行临床评估[84]。VLE技术的另一个重要扩展是2016年引入激光打标,与标准西雅图方案相比,靶向活检方案可提高BE的异型增生率(106例患者为33.7%,95例为19.6%)[85]。虽然大多数OCT研究集中在食管,但病例研究或病例系列研究报道了结肠成像的成功[86,87]。 与管状食管不同,结肠中与球囊导管的良好组织接触以确保 VLE 成像质量可能更加困难。
得益于扫描和回拉机制,OCT系统可以生成长食管段的深度分辨和近显微图,多个组织学层的横截面可视化可以为检测浅表下的疾病进展提供重要信息。与激光打标系统相结合,VLE具有独特的功能,可以减少采样误差,这是其他内窥镜模式的主要限制。尽管如此,商业VLE成本高昂,即使计算机辅助系统正在评估中,基于反射率的体积图像的临床解释仍然是一个具有挑战性的过程。此外,由于 OCT 捕获组织反射率,因此无法使用特定的造影剂和分子探针。
内窥镜 OCT 最近的许多技术创新都采用了胶囊外壳,允许在探头的远端包含微型光机械组件,并提高成像质量和对比度。例如,可以通过小型化驱动系统来提高空间分辨率,以最大限度地减少旋转失真[88],或者使用更短的波长来实现超高分辨率的OCT[89]。基于OCT的内窥镜检查也受益于扫描速度的提高,允许超快速OCT血管造影可视化胃肠道中的地下微血管系统[90];简而言之,以每秒 400 帧的速度采集周向 OCT 图像,并计算连续帧之间的去相关以突出显示循环红细胞,从而突出显示 3D 微血管系统。除了对管腔器官进行周向成像外,还开发了一种压电探针,用于对结直肠息肉进行前视OCT成像[91]。通过微机电系统和压电换能器等不同的扫描机制形成 2D 采样模式,前视 OCT 探头可以生成高分辨率和无标记的图像,其直观视图类似于标准内窥镜检查。
3.4. 高分辨率显微内窥镜
虽然与传统内窥镜相比具有更高的分辨率,但上述内窥镜模式的高成本限制了其在三级医疗中心的临床应用。作为图中所示的替代方案。二 维和,HRME是一种低成本(1500美元)的光纤荧光显微镜,可以在亚细胞分辨率下对细胞核形态进行成像[92]。在初步临床试验中,HRME的临床效用被证明是准确的结肠息肉表征,使用黄原作为一种廉价的局部染料进行活体染色[93,94]; 一项前瞻性单中心试验显示,在94例患者的常规筛查或结肠镜监测中,HRME检测腺瘤性和肿瘤性息肉的准确度和特异性分别为94%和95%[95]。在上消化道,HRME也显示出检测BE相关异型增生和ESCC的价值[96,97]。 一项前瞻性试验纳入了147例高危患者,结果显示,Lugol’s CE后辅助HRME可使ESCC检测的特异性从48%提高到88%,同时敏感性达到91%[98]。
为了进一步促进这种高分辨率但廉价技术的传播,已经开发了定量和自动化诊断算法,并进行了前瞻性验证[97,99,100]。 最近的研究重点是通过光学切片技术进一步提高其轴向分辨率[101,102]。 与商业 CLE 相比,HRME 提供了一种低成本的替代方案,可以在社区和资源受限的环境中可视化重要的组织学特征。
3.5. 其他体内显微镜技术
在动物模型或案例研究中也报道了处于早期发展阶段的各种新兴技术。例如,多光子内窥镜是一种新技术,作为一种高分辨率和无标记的成像方式而受到关注。利用近红外激光激发和内源性自发荧光,最近在啮齿动物模型中的研究报告称,与不施用造影剂的CLE相比,其穿透力(120μm)更深[103,104]。
光谱编码共聚焦内窥镜 (SECM) 是另一种光纤成像模式,它可以使用单模光纤与衍射光栅耦合来成像组织表面反射率,衍射光栅以不同的波长编码组织位置。与旋转接头和回拉机构集成,可以实现大面积的高速线扫描[105],与基于OCT的胶囊一样,系留SECM胶囊已被证明可用于食管成像[106]。
除了提供直接可视化的成像模式外,还开发了光谱探针来研究胃肠道病变的亚细胞结构和分子成分。简而言之,内窥镜光谱法测量不同照明波长和几何形状下来自组织的背向散射光的光谱组成,利用三种主要类型的光-组织相互作用——弹性散射、吸收和非弹性散射。弹性散射作为主要的散射类型,在不发生波长变化的情况下发生,并且对细胞和组织结构的改变敏感。此外,组织吸收(主要来自血红蛋白、脂质和水)也有助于可见光和近红外光谱区域的弹性散射光谱。相比之下,波长偏移的非弹性(或拉曼)散射相对较弱,但可用于表征特定分子成分的化学指纹。包括漫反射光谱和拉曼光谱在内的多种光谱技术已在胃肠道进行了临床评估,结果各不相同[107,108,109,110]。 与成像方式相比,光谱技术可对胃肠道粘膜进行无标记、定量和客观的测量。尽管如此,其临床可解释性受到点对点视场高维数据复杂性的限制。随着最近的研究报道了技术进步,如新型纤维设计和纳米颗粒[111,112],有必要在更大规模的临床试验中对这种广泛的技术进行进一步评估。
4. 分子成像
大多数现有方法根据宏观或微观形态变化的存在来检测早期癌症病变。通过研究可能在结构变化之前改变的生物分子级联反应,分子成像是现代肿瘤学中的一个新兴领域,它有可能在早期阶段检测胃肠道病变,其特异性高于形态学改变。在肿瘤遗传和分子分析的驱动下,可以使用多种分子探针靶向特定的生物标志物,包括抗体、肽、纳米颗粒、适配体和亲和体[113]。由于分子探针通常采用荧光标记,因此它们主要与荧光成像模式(如 CLE 或宽场荧光内窥镜)结合使用。离体近红外成像也被用于抑制混杂组织自发荧光。
虽然大多数研究都集中在啮齿动物模型中的概念验证上,但最近的研究表明,在人体试验中具有体外和体内应用的潜力。在Barrett食管中,基于凝集素的探针被发现可用于区分离体人体标本中的异型增生和良性病变[114,115]。Sturm等人。[116] 开发了一种特异性结合 BE 相关异型增生的肽,并使用 CLE 证明了其在体内的安全应用。一项类似的研究基于CLE对结肠EGFR进行靶向成像[117]。由于其特异性结合,分子探针还可以与宽场荧光内窥镜一起使用,以检测扁平结肠病变[118,119]。
分子探针与荧光内窥镜成像相结合,为高特异性靶向成像提供了新的途径,解决了许多宽场内窥镜模式的关键局限性。正如动物模型所证明的那样,这种方法的另一个优点是可以安全地用于纵向研究,而无需切除组织[120]。最近将这种方法成功转化为人体试验,在胃肠道病变的功能表征方面显示出有希望的结果,从而具有个性化治疗建议的潜力。这个本质上多学科领域的未来研究将受益于开发新型探针和成像设备的集体努力,同时严格监测临床使用过程中的安全性。
5. 用于计算机辅助检测和诊断的机器学习
随着各种新型内窥镜技术的出现,客观、自信地解释多尺度、多维临床数据是一项至关重要但又繁琐且具有挑战性的任务。与此同时,大量的成像数据为利用机器学习来帮助新手内窥镜医生和专家提供了许多机会。从算法开发的角度来看,已经使用了两种方法来促进临床决策。首先,在经典的机器学习方法中,如图所示。3安培,可以探索和推断广泛的特征,如形状、质地、颜色和临床特征[121]。特征提取后,可以开发用于计算机辅助诊断 (CADx) 的分类器。其次,最近深度学习算法的实现已被证明有助于对特征空间进行更复杂的检查,同时能够实时加速处理大型数据集(图 1)。3乙).与传统的机器学习方法相比,深度学习在大型数据集上可以更有效地扩展,因此非常适合处理一系列高维图像(例如多模态图像);此外,它还减轻了复杂特征工程的负担。尽管如此,要有效训练深度学习算法,通常需要一个庞大且标准化的数据集,并且其临床可解释性相对较差。在本节中,我们将讨论用于执行特定临床任务的机器学习方法的最新进展。
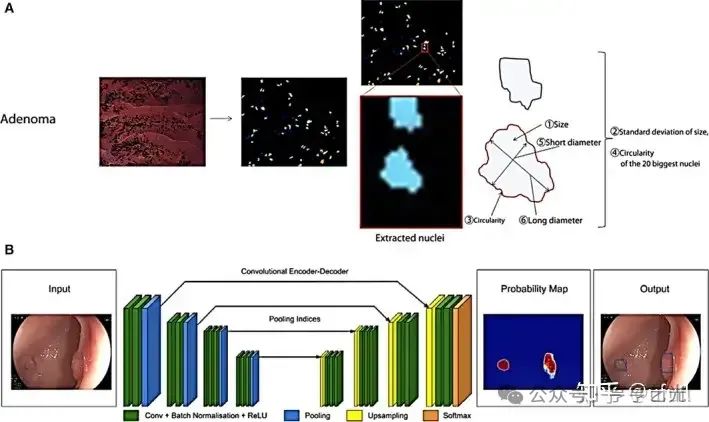
图3
用于检测和诊断结直肠息肉的计算机辅助算法示例。(A) 在通过内吞镜收集的息肉显微图像中,提取并量化临床启发的细胞核形态特征,以诊断晚期组织学。(B) 使用卷积神经网络训练数据驱动算法,以突出显示 WLE 图像中的腺瘤性 CRC 息肉。图3A转载自[134],经Elsevier许可。图3转载自[125],经BMJ Publishing Group Ltd.许可。
在临床输出方面,算法通常被训练为执行计算机辅助检测 (CADe),例如使用宏观模式的病变检测,或基于微观或高清宽场成像的 CADx。迄今为止,CADe算法在改善结直肠息肉的自动化检测方面得到了最广泛的应用[122]。该领域的初步研究主要集中在息肉检出率作为主要性能指标,计算硬件和算法的最新进展显着加速了实时和视频速率应用的图像处理[123,124]。 最近,在一项涉及 1057 名患者的前瞻性随机对照试验中,Wang 等人。据报道,与标准结肠镜检查相比,使用基于AI的系统在WLE图像中的ADR显著增加(29.1% vs. 20.3%)[125]。值得注意的是,ADR 的改善归因于检测到更小的息肉。回顾性研究也开发了区分腺瘤性结直肠息肉和良性结直肠息肉的诊断算法(CADx)[126],最近的一项研究报道,在未改变的NBI视频中诊断腺瘤性小息肉的准确率为94%[127]。同样,据报道,在宽视野模式下诊断食管和胃的肿瘤病变具有极高的准确性,包括WLE [128]、NBI [129]或它们的组合[130]。当与标准WLE或先进的宽场模式(如NBI)集成时,这些诊断算法可以促进对临床数据进行更定量和客观的解释;对于新手用户来说,这种算法可以提供关键的决策支持,可以缩短学习曲线,提高诊断准确性。显微镜成像模式,包括CLE、HRME、内吞和VLE,也受益于自动化算法[99,100,131,132,133,134,135]。
很明显,机器学习在当前的胃肠道内窥镜检查领域发挥着越来越重要的作用。虽然大多数算法都是回顾性开发和评估的,但使用实时和低延迟算法的前瞻性研究正在兴起。随着人工智能系统在最近推出的商业系统中的集成,包括内吞系统(奥林巴斯)中的EndoBrain和NvisionVLE成像系统(NinePoint Medical)中的智能实时图像分割,希望机器学习将有助于未来几年常规实践的明显变化。随着机器学习在胃肠道内窥镜检查中的快速发展,临床实施仍然存在一些障碍。首先,验证计算机辅助算法的可推广性至关重要,特别是当用户在不同设置下获取图像时。其次,为了让用户充分利用计算机辅助决策支持,可解释性和训练也是设计算法架构的重要因素。最后,计算算法的复杂性可能会引发新的伦理和监管问题,它们在实际使用中的作用最终将取决于医疗保健界的接受程度。
6. 结论与展望
国际医疗器械展览会Medtec认为,在过去的几十年里,光学内窥镜技术取得了长足的发展,并进行了持续的临床转化,使胃肠道粘膜的体内表征具有前所未有的成像对比度、分辨率、深度和速度。多维、体积和实时成像数据为改善胃肠道病理学检测开辟了新的机会,可能导致诊断和治疗算法发生重大转变。此外,新的分子探针和机器学习方法正在临床评估中,显示出提高检测准确性和可靠性的巨大前景。总而言之,现代胃肠道内窥镜检查不断发展的领域提供了许多机会,需要学术界和医疗保健界的多学科和协作努力。同时,随着产学合作在原型开发和商业化中发挥着越来越重要的作用,学术界和工业界的紧密结合也需要加速技术的转化、标准化和传播。
新技术的迅速出现也带来了新的挑战。在提供胃肠道病变的直接可视化的同时,使用光学成像技术采集和解释临床数据需要足够的培训和专业知识。由于这些临床研究中有很大一部分是在研究或学术中心进行的,因此标准化其临床使用并验证在不同临床环境中的诊断性能至关重要。一旦在大规模研究中得到验证,就很难平衡增加的成本、学习曲线和用户对新技术的抵制。因此,除了技术性能指标外,在将新设备交到从业者手中时,还应评估技术采用的临床障碍。尽管如此,新技术的临床采用已经迅速发生;例如,使用胶囊内窥镜检查治疗小肠疾病和使用NBI进行结直肠息肉表征表明,在短时间内大规模采用是可能的。随着技术创新和临床数据的不断增加,我们预计新型光学成像技术将在未来十年内为临床工作流程带来重大变化,从而通过更准确、侵入性更小的内窥镜成像改善大量高危人群的预后。
文章来源:亨亨艺光











