根据医疗器械行业展览Medtec调查发现,房颤冷冻消融,是一种微创介入手术,属于介入冷冻治疗技术,是房颤消融的三大技术路线之一。房颤冷冻消融将冷冻消融技术与导管技术相结合,对心脏异常组织进行快速冷冻,使靶组织温度迅速降低,破坏异常组织细胞,从而达到房颤治疗目的。房颤冷冻消融是在房颤射频消融之后开发出的一种新型心律失常治疗技术。
冷冻球囊消融是将液态制冷剂由体外沿导管输送到末端的球囊,在球囊内释放液态一氧化二氮,一氧化二氮汽化形成低温,使周围组织冷冻,细胞坏死形成不可逆性损伤,从而破坏异常电信号。冷冻造成细胞和组织的损伤是通过即刻效应和延迟效应实现的。即刻效应包括低温应激和直接细胞损伤;延迟效应是由于复温时的组织破坏,包括细胞内再结冰和破裂、血管介导的损伤。
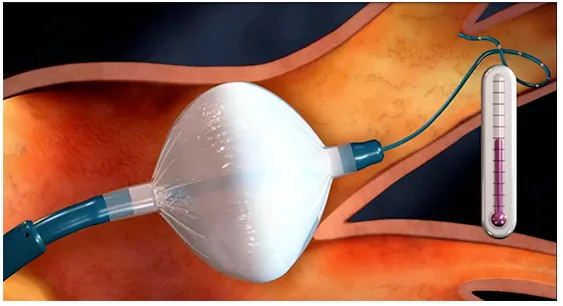
与射频消融相比,冷冻球囊用于肺静脉消融具有导管稳定性更好、产生的瘢痕边界连续均匀、瘢痕表面心内膜损伤小、相邻组织完整性好、患者不适感少等优点。
冷冻球囊消融的程序相对简单,在一定程度上缩短了手术时间并减少了 X 线照射量。由于其技术更易于掌握,学习曲线短,因此更容易在临床上推广普及。2017年Rui Providencia等人在EuroPCR上发表的一项研究表明,冷冻球囊房颤成功率更易复制,在不同容量的中心,冷冻球囊消融有效性集中在70%-80%,而射频消融的有效性为30%-80%。
冷冻球囊自1999年开始作为一种消融能量应用于临床,已历经四代发展。
第一代冷冻球囊靠近球囊近端内置 4 个冷冻剂喷射头,在赤道位形成环形冷冻区域,远端冷冻效果较小。
2005年产生的第二代球囊外形与一代球囊相同,但做了四处改进。一是冷冻剂喷射头由4个增加至8个,且分布到远端,使得球囊顶部至远端都能达到有效均一的冷冻效果,球囊表面温度一致率由 47% 提高到 83%;同时组织渗透能力明显提高,缩短了冷冻所需时间;二是球囊表面冷冻区域由环形改为半球形,尖端椭圆形设计更加适合肺静脉口部形状,增大冷冻球囊与肺静脉的接触面积;三是输送鞘可折叠段的弯曲度增至135度,提高了柔韧性。四是球囊内芯伸缩杆缩小至2mm,增加变形能力,提高适应性。
2015年第三代冷冻球囊面世,远端螺旋电极在第二代的基础上与球囊距离进一步缩短,能更好地实现消融过程中对肺静脉电位的记录。
第四代冷冻球囊远端到尖端的长度进一步缩短至8mm,且与前几代球囊相比,同轴连接器可旋转35°;球囊内的冷冻线圈进一步前移,使得前端冷却更为充分,技术也向更加高效、精准、均一的方向发展。但目前临床广泛应用的仍是第二代冷冻球囊产品。
影响冷冻消融损伤的因素
压缩成液态的NO近入冷冻球囊后通过蒸发带走热量,进而使其周围心肌组织降温,产生冷冻消融损伤。以下因素会影响损伤范围。
(1)不可控因素:①最低温度,是指冷冻过程中与冷冻球囊接触部位组织的最低温度。它是决定细胞内结冰的主要因素,温度每降低10℃,损伤深度可增加0.38 mm,温度越低组织损伤越难恢复。注意,冷冻过程中测得的温度是球囊内回收到的NO气体的温度,并不是组织的温度,但通常与组织的温度有一定的相关性。②降温的速度,降温越快越有利于细胞死亡,降温越慢越有利于保留细胞的功能,所以冷冻过程中要重点观测温度降低的速度。③复温的速度,复温时细胞外液会流到细胞内,增大细胞内冰晶体积,所以复温越慢会有越多的细胞外液留到细胞内,会有更多的细胞死亡。冷冻过程中要关注复温的时间。复温时间超过30s,预示着冷冻的效果好。
医疗器械行业展览Medtec将于2025年9月24-26日在上海世博展览馆举办,2024 Medtec汇聚近1000家来自全球近27个国家的优质品牌供应商,为中国医疗器械生产厂商提供产品研发、生产、注册所需的设计及软件服务、原材料、精密部件、自动化制造设备、超精加工技术、合同制造、测试和认证、政策法规和市场咨询服务,展品覆盖医疗器械设计与制造全产业链。Medtec China致力于为中国医疗器械生产企业技术发展提供丰富资源和先进理念,为跨国医疗器械生产商在中国设立研发和生产基地提供有力支持。点击报名参展>>>
(2)可控的因素:①冷冻的时间。冷冻损伤的范围在一定区间内与冷冻的时间成正比,降温超过一定的时间并不会继续增大。冷冻的时间在2 min时可形成稳定的透壁损伤,深度在3~4 mm。②冷冻次数。依据冷冻消融导管的数据,两次冷冻可以增大损伤的范围。③球囊与组织的贴靠。冷冻过程中有贴靠就有损伤。贴靠不良的部位即使延长冷冻时间也难以产生有效损伤。所以冷冻过程中一定要确保球囊和肺静脉前庭达到良好的贴靠再开始冷冻。
术中要观测肺静脉隔离时间(TTI)。当TTI<60 s时预示着持续性的肺静脉隔离,标志着冷冻消融效果较好。反之,如果TTI>60s则预示着可能会出现肺静脉恢复传导,需要调整球囊的位置再次进行冷冻消融。
冷冻消融面临的挑战
目前冷冻球囊消融一个显著不足是适应证偏窄,冷冻球囊导管是专门针对肺静脉解剖结构而设计研发,专一性较强,主要应用于肺静脉隔离术。若阵发性房颤的患者伴有典型心房扑动、非肺静脉起源触发灶,则需采用射频消融对患者病灶进行消融。由于冷冻球囊难以进行线性及碎裂电位消融,其对于持续性房颤及部分阵发性房颤疗效有限,未来可以对此拓展,进行环肺静脉消融之外的基质改良,如左房顶部、左心耳嵴部消融等,以提高疗效。
冷冻球囊消融面临的另一挑战就是肺静脉解剖变异,最常见的肺静脉变异为左肺静脉共干和右中肺静脉,而直径较大的共干肺静脉及直径较小的中肺静脉可能会增加冷冻球囊消融的难度,降低消融治疗的成功率。
同时,冷冻消融技术另一个尴尬的地方在于,作为一项相对新兴的治疗方式,其尚未获得大规模的临床推广,就要面对更新的技术形态的挑战。
比如,医疗器械行业展览Medtec认为,脉冲电场消融(PFA)作为一种非热能消融技术,具有高安全性和快速消融的特点,被认为是下一代颠覆性消融技术,其在近年来的快速崛起,也对冷冻消融技术的研发热度造成了一定的影响,未来冷冻球囊消融将面临越来越大的竞争压力。
1. 中国心血管医疗器械产业创新白皮书2021
2. 谢敏, 崔凯军. 冷冻球囊消融在心房颤动一线治疗中的应用现状与展望. 华西医学, 2024, 39(4): 640-644. doi: 10.7507/1002-0179.202309152
3. 尤华彦,王如兴. 心房颤动冷冻球囊消融的临床应用进展[J]. 实用心电学杂志, 2019, 28(4): 266-272.
文章来源:医心












