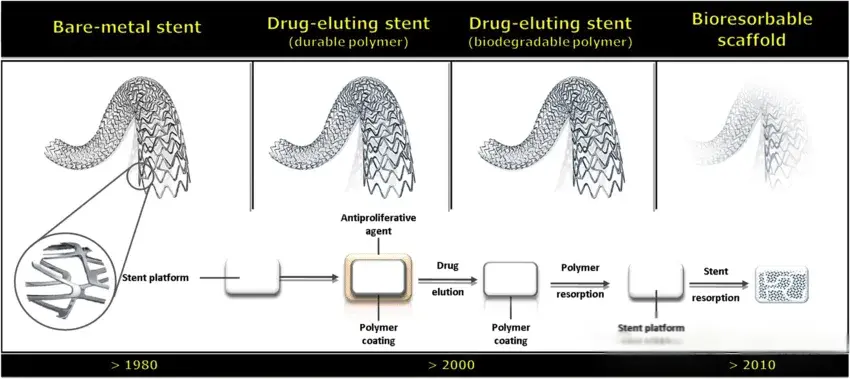
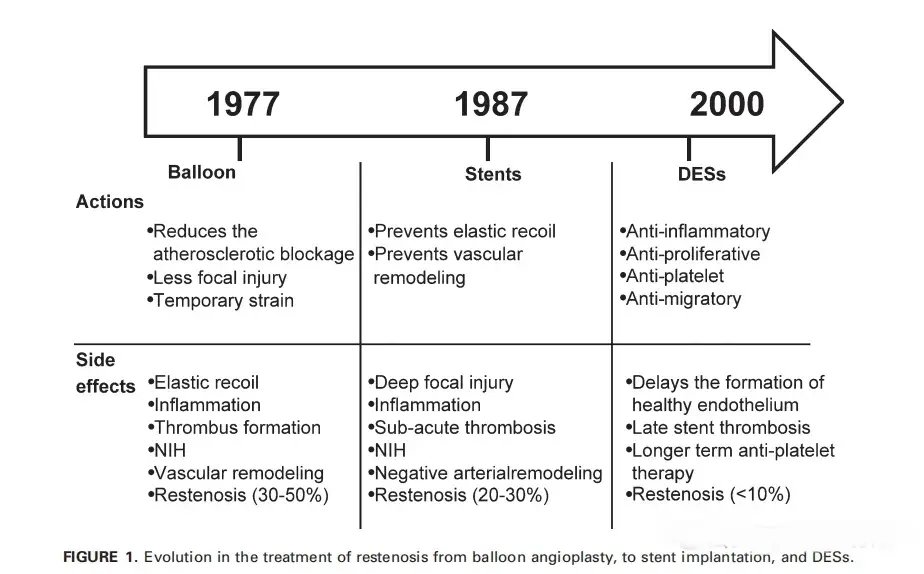
血流导向已成为多种动脉瘤形态和部位的标准治疗手段。FDs运用于动脉瘤治疗中的效果已经不需要进一步的赘述,但在安全性上依然是大家关注的重点。最早的密网支架通常采用裸金属制成,没有额外的表面涂层。这些支架虽然在血管内具有足够的强度和弹性,但裸金属密网支架在血液中直接暴露,可能引起凝血、动脉内皮增生等问题,增加了术后栓塞的风险。因此,这一阶段的密网支架需要长期使用双重抗血小板药物(DAPT)来防止血栓形成。长期双重抗血小板药物的使用,也使得动脉瘤有了额外的出血风险。FD治疗的破裂动脉瘤患者与在 ISAT 试验中经血管内栓塞治疗的患者相比,动脉瘤再出血率更高(4%–5%),而后者再出血率为 2.7%[6]。
为了减少使用FDs后的缺血并发症,抗血小板药物的使用是必不可少的。但是长时间的DAPT除了有可能会增加出血并发症,还有可能会影响动脉瘤本身的愈合。一项多中心的研究显示:在使用单一Pipeline(PED)治疗未破裂颅内动脉瘤后,延长双重抗血小板治疗(DAPT)时间(超过6个月)可能会导致动脉瘤持续充盈和未闭塞。在FDs治疗后,建议采用不超过6个月的双重抗血小板治疗,随后转为低剂量阿司匹林单抗治疗,以促进动脉瘤闭塞,同时尽量减少延迟性血栓栓塞并发症的风险[10]。
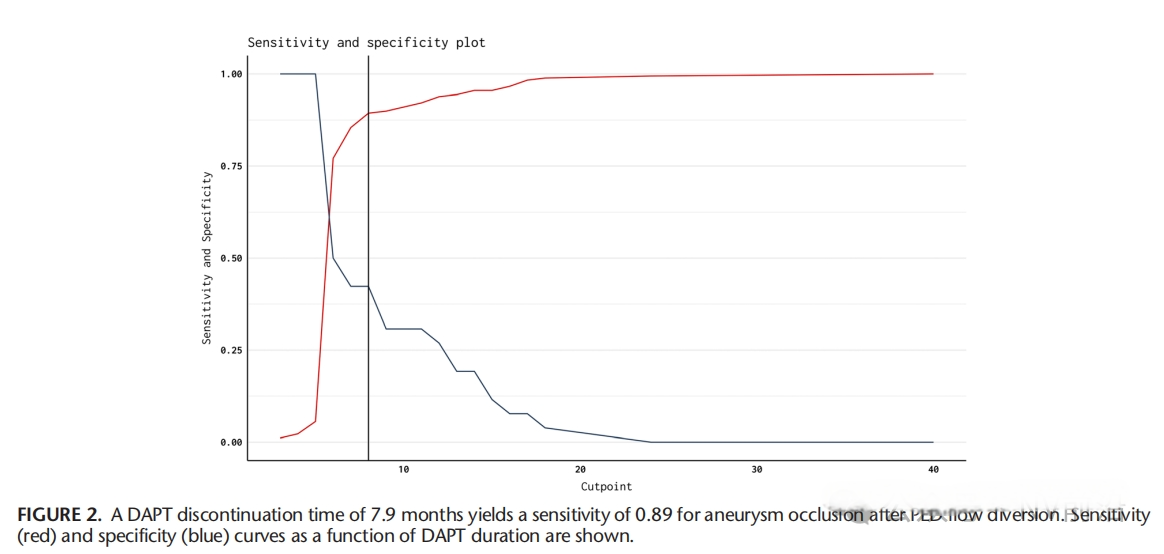
(The Impact of Dual Antiplatelet Therapy Duration on Unruptured Aneurysm Occlusion After Flow Diversion: A Multicenter Study)
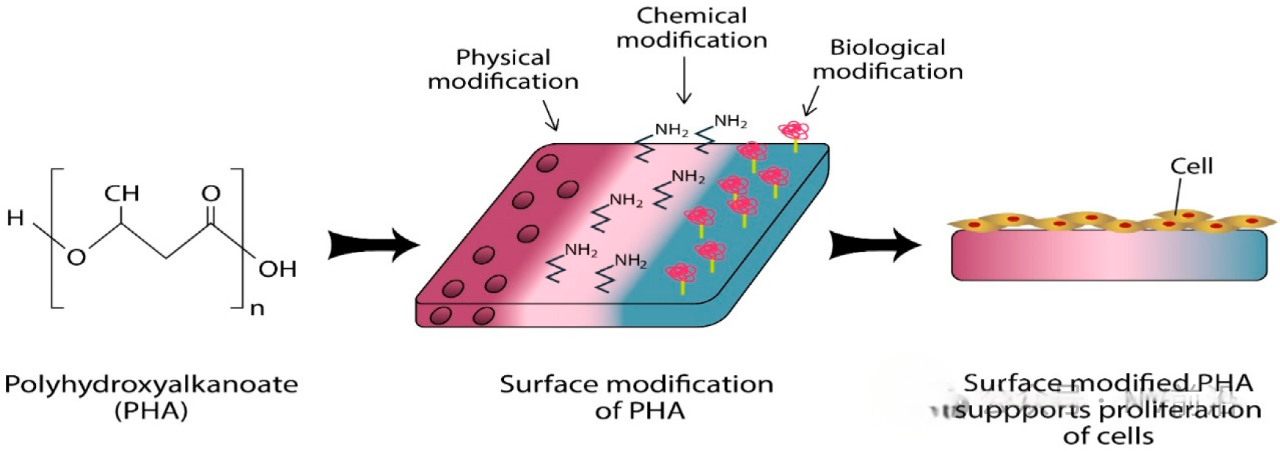
和冠脉支架的发展历程类似,大家对如何设计一款理想的FDs(工程学上的)已经有了一定的共识,支架与支架之间从物理性能上的区别似乎也已经越来越小。为了更进一步的提高密网支架的有效性和安全性,表面修饰的涂层技术很有可能会成为下一个研发工程师们会争夺厮杀的新赛道。
表面修饰可以分为机械修饰,化学修饰和物理修饰。研究表明,粗糙表面更容易形成血栓,因此表面处理对于获得无污染、光滑的支架材料表面至关重要。支架的多种表面处理方法包括机械抛光、电抛光、超声清洗、化学蚀刻和脱脂,以及低压等离子蚀刻。电抛光具有多项优点,使其成为最受欢迎的表面处理方法。首先它可用于复杂基材形状(如血管内支架),从而产生良好钝化的、光滑且无缺陷和污染的表面。其次,它可以去除导致各种腐蚀过程(特别是局部腐蚀)的一些非金属夹杂物和不规则性。电抛光过程中,金属在合适的电解质溶液中作为阳极极化,并与金属阴极一起进行。多种参数影响电抛光过程,如阳极电流密度、施加电势、电解液温度、抛光时间、电解液成分和浓度、搅拌方式以及阳极与阴极的表面积比(即两电极之间的几何间隙)。一些研究报告表明,冠状动脉支架材料的抛光可减少血栓和纤维蛋白原的沉积,并可能在动物模型中减少新内膜增生。为了防止支架产品的氧化和劣化,在电抛光后进行表面钝化[7]。
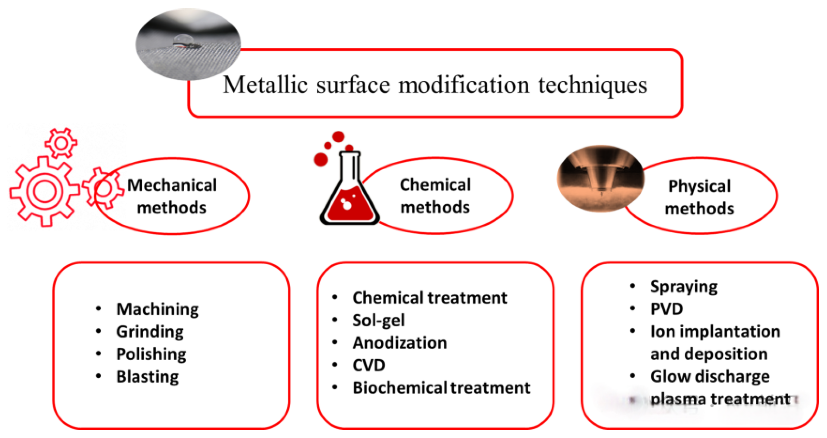
还有一种方式是在支架上添加有机聚合物。多种生物相容性聚合物如磷酸胆碱、透明质酸、纤维蛋白和肝素被用作被动有机支架涂层。生物相容性涂层至少应提供一种减少不良组织反应的表面,或更优是模仿一种可促进支架植入部位愈合的生物基质。磷酸胆碱、透明质酸、纤维蛋白和肝素是从植物和动物来源中提取的天然生物聚合物[7]。
Demetrius Lopes教授在2020年总结了在使用FD过程中血栓形成的主要原因包括:
3. 高凝状态 – 可能由于对抗血小板药物反应不良或肝素诱导的血小板减少症而引起
为降低支架的血栓形成性,表面修饰自然的成为下一步。当前用于降低血栓形成性的几种方法包括:
1. 电抛光 – 镍钛材料比不锈钢吸附更少的血小板和血浆
4. 磷酸胆碱 – 模仿红细胞膜,已用于Pipeline Flex血流导向装置
碳化硅(SiC)是一种富含氢的无定形半导体,与裸金属支架相比,可能具有更低的血栓形成性和炎症反应。SiC涂层支架的体外研究表明纤维蛋白和血栓形成显著减少。人体研究显示,与裸金属支架相比,SiC涂层支架的急性血栓形成率较低,但对NIH(新内膜增生)影响不显著[8-9]。

通过支架本身的表面修饰的作用,目的是在不增加缺血性并发症的风险下,通过抑制血栓的形成,进而减少DAPT的使用时间。接下来我们一同来看看目前国内外主流具有抗血栓形成表面修饰的血流导向装置都有什么特点。
2014年Medtronic推出了了具备“SHIELD”技术的PED Flex Shield,这是一种被称为第三代的血流导向装置。PED Flex Shield与其“裸金属”前代产品的关键设计差异在于金属管道编织层(75% 钴铬,25% 铂/钨)上共价结合了一种磷酸胆碱聚合物。磷酸胆碱是一种中性、两性离子且天然存在的磷脂聚合物,构成人体红细胞膜的重要部分。它具有血管相容性和非致敏性。在体外的人体血液流体模型中,对该支架表面进行扫描电子显微镜检查时,观察到微血栓形成减少[11]。这种涂层为支架提供了生物仿生特性,特别是模拟细胞磷脂膜。最近发布的一项单臂多中心观察研究(SHIELD)主要目的是确定使用该装置治疗动脉瘤的血管造影闭塞率及病变区域的主要卒中率。在七个中心的151名患者中,85%的患者在12个月内达到了血管造影闭塞率。神经系统并发症(包括卒中)仅见于6.6%的患者。值得注意的是,在该系列研究中,患者仍需在六个月内服用双抗血小板药物。在另一个对50名使用Shield装置治疗的患者的系列研究中,Galdamez MM等人报告了6例支架内血栓病例。Pikis及其同事通过磁共振成像显示,在Shield装置治疗动脉瘤后72小时内,检测到无声弥散受限(silent diffusion restriction,不确定是不是这个翻译,囧)水平的降低,进一步展示了其降低血栓形成的特性。随着更多长期随访数据的出现,期待对Shield技术的PED装置疗效有更完整的理解。
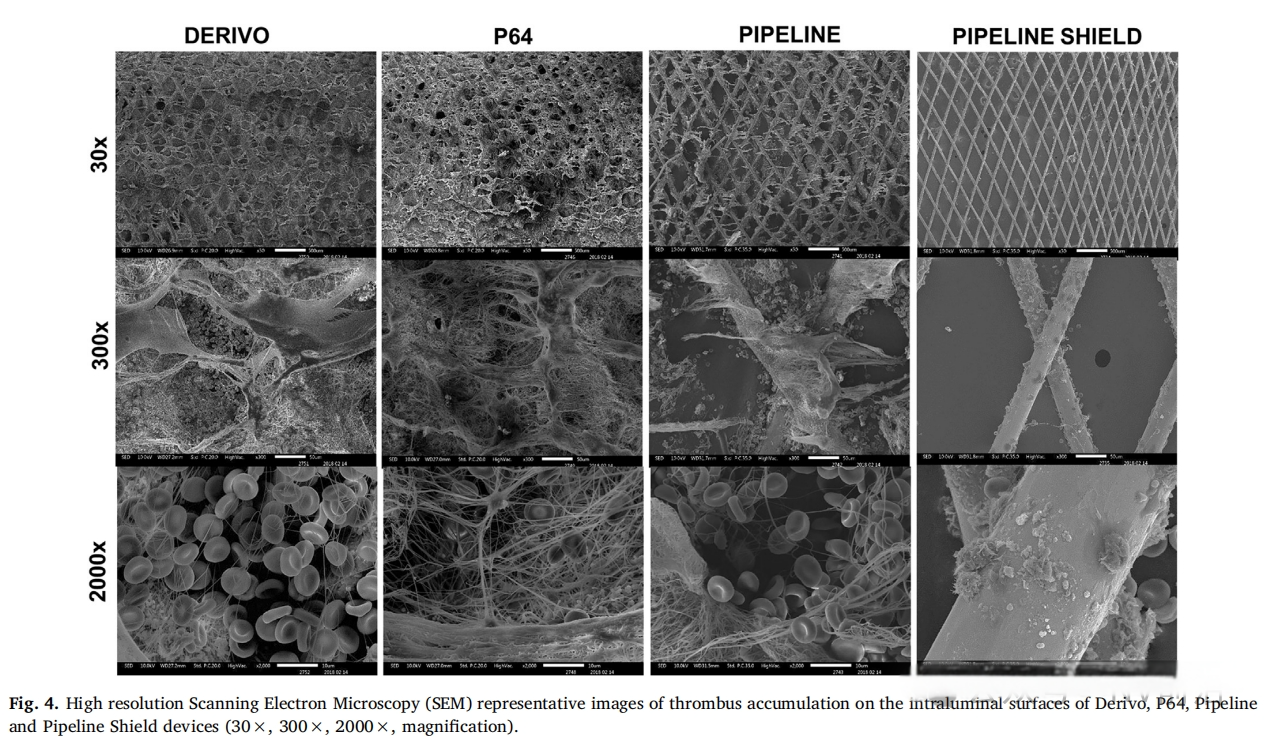
(Thrombogenicity assessment of pipeline, pipeline shield, Derivo and P64 flow diverters in an in vitro pulsatile flow human blood loop model)
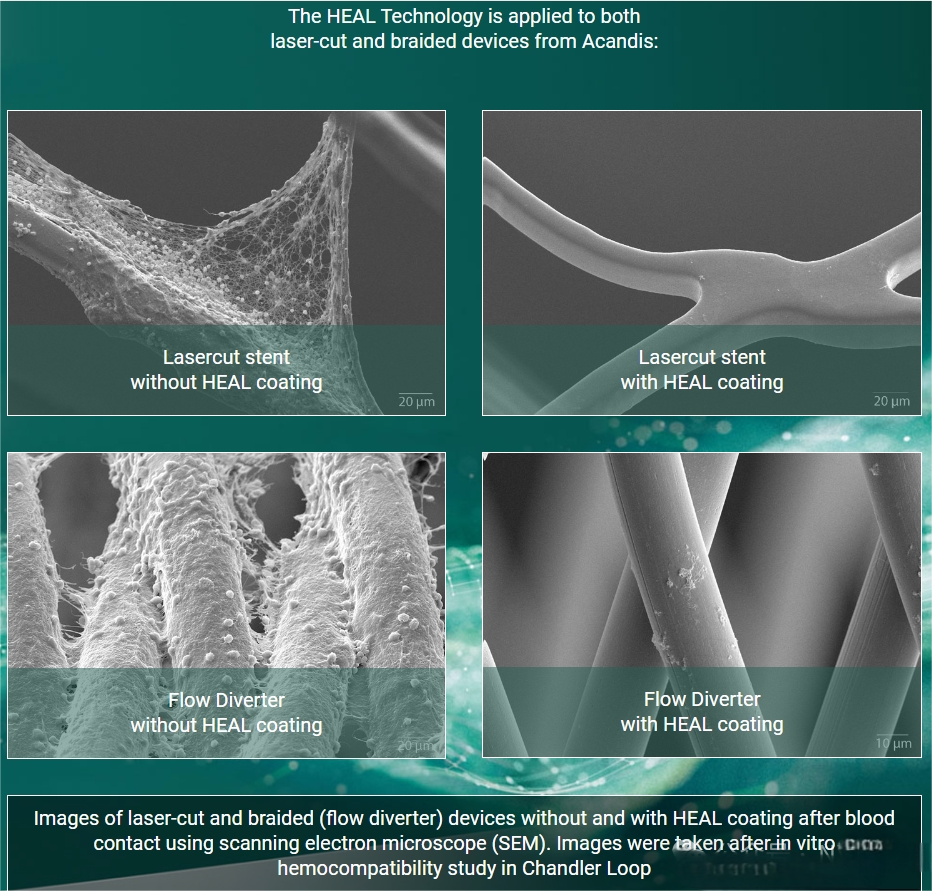
Derivo Embolization Device
Derivo栓塞装置(DED,Acandis)于2016年推出,采用24根镍钛合金丝,带有放射性不透明的铂芯环。该装置经过50纳米氧化钛表面处理(涂层),理论上可降低输送和打开过程中的摩擦并最终减少血栓形成。Taschner及其同事报告,在一项包含119名患者的前瞻性多中心研究中,主要发病率(改良Rankin量表大于3分)为3.1%,主要卒中率为4%[12]。在1年时89%的患者实现了动脉瘤闭塞。在巴西的多中心BRAIDED试验中,报告的“重大不良事件”率为5.5%,同样在1年时血管造影闭塞率为89%,长期结果数据尚待公布。Derivo的涂层是用了Acandis公司的“HEAL Technology”。“HEAL Technology”模拟了自然止血的最后一步,即通过凝血酶将纤维蛋白原转化为纤维蛋白。其受控的生长过程产生了一个薄且完全聚合的纤维蛋白网络,并额外共价结合了肝素分子。这种HEAL涂层的成分赋予了抗血栓性和促进内皮化的特性,这对于颅内装置的快速愈合至关重要。纤维蛋白对表面进行钝化,使植入物不会被视为异物,因此不会触发炎症或凝血过程。钝化作用显著降低了血栓形成的可能性。同时,纤维蛋白网络为周围的内皮细胞形成了理想的支架,从而支持内皮化并促进植入物在血管中的愈合。

Phenox Flow Modulation Device
2017年推出的p64/p48(HPC,Phenox GmbH)配备了亲水聚合物涂层技术,由铂和镍钛合金编织而成。它采用一种专有的共价结合涂层,可模拟血管壁糖萼并抑制血小板凝块形成。在28例经HPC治疗的破裂和未破裂动脉瘤患者的临床小样本系列中,无患者出现临床显著的支架内血栓形成,但多数患者接受了双抗血小板治疗[13]。尽管有2例血栓栓塞事件,但未见长期发病率或死亡率。虽然87%的病例实现了完全闭塞,但有趣的是,术后弥散加权(DWI)MRI显示70%的患者有病灶。

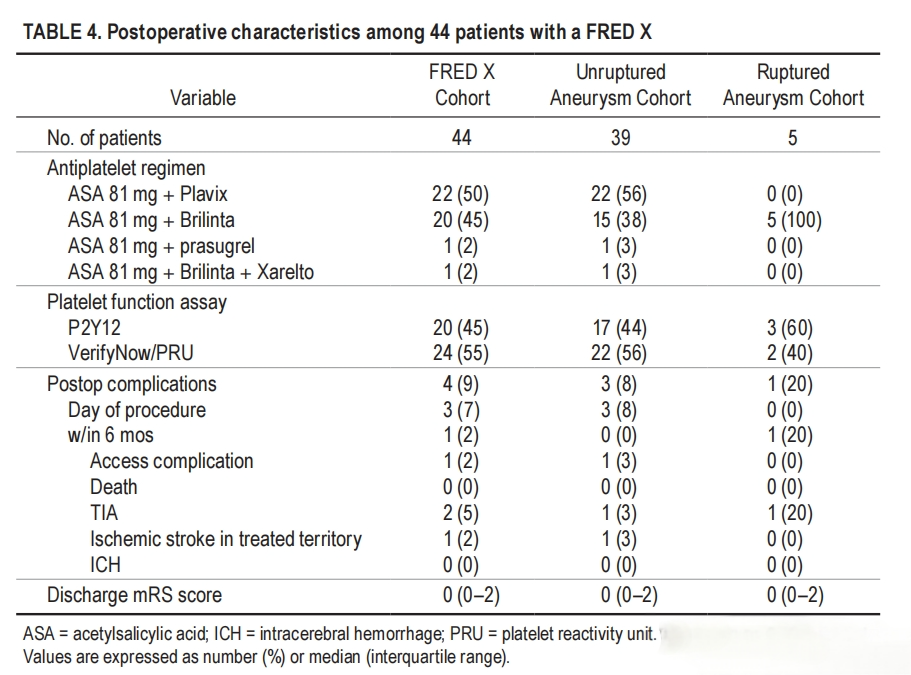
Flow redirection endoluminal device with X technology(FRED X,MicroVention)于2021年9月获得FDA批准。FRED X是基于原始的FRED系统,使用自膨式编织镍钛网来帮助重新引导血流并促进动脉瘤闭塞。FRED X的涂层使用了Terumo的“ X technology”,这是一种专有的纳米级表面处理技术,通过共价键永久地改变支架表面化学性质。“ X technology”在支架表面形成优化的保护性水合层,旨在允许支架表面选择性地附着。FRED X的设计不仅降低了材料的血栓形成性,同时也维持了血管的自然愈合反应。FRED X还减少了输送和回撤的摩擦力,使其在曲折解剖结构中更易推送。Rawad Abbas等人通过分析美国4个三级脑血管中心的FRED X使用者收集的前瞻性数据,回顾性评估FRED X的可行性、安全性和有效性。研究最终纳入44例患者,共治疗45例动脉瘤,使用了46个FRED X装置。所有病例的支架均放置成功,实现了支架贴壁良好和颈部完全覆盖,61%的病例中观察到动脉瘤瘤内造影剂滞留超过90%。术后并发症方面,未破裂动脉瘤组中有3例(8%)出现症状性并发症,破裂动脉瘤组中有1例(20%)出现短暂性脑缺血发作。所有患者在治疗后均出院,且出院时的mRS评分为0。随访结果显示,6个月时,89%的病例实现了完全闭塞,6%的病例出现了无症状的支架内狭窄,所有患者均有良好的功能预后。12个月时,5例患者的血管造影和临床随访显示,4例患者(80%)动脉瘤完全闭塞,1例患者(20%)有瘤颈残留[14]。

(First United States multicenter experience with the new-generation FRED X surface-modified flow diversion stent: feasibility, safety, and short-term efficacy)
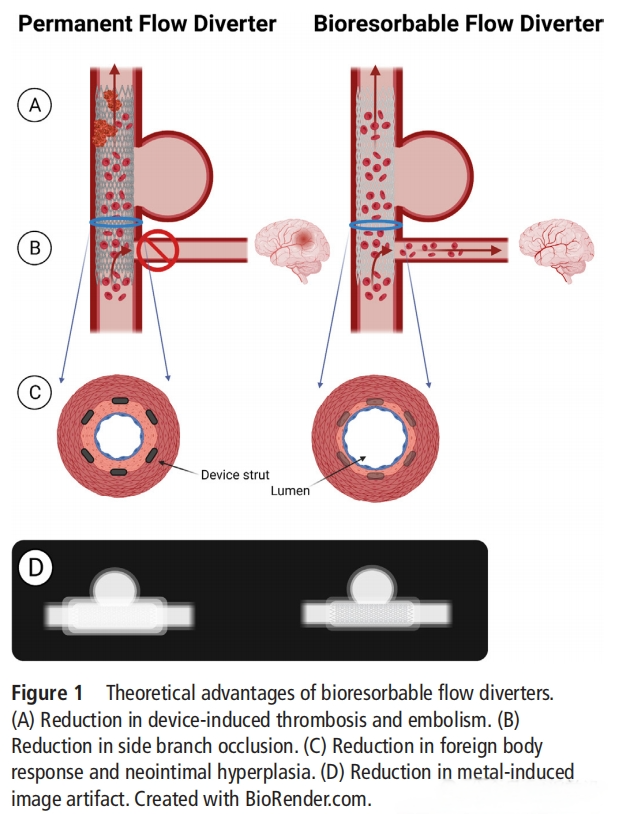
2024有源医疗器械创新论坛在前面提到过“鸟尽弓藏”是治疗过程中的一个理想状态,生物可吸收的血流导向装置(BIORESORBABLE FLOW DIVERTERS,BRFDs)正在慢慢进入大家的视野。理想的BRFD在闭塞和修复动脉瘤后可被人体无害吸收,从而消除当前支架永久存在所带来的并发症风险。尽管BRFDs的概念相对较新,但生物可吸收的冠状动脉支架已经进行了广泛研究,并有多种设备迭代和材料进入临床。这些研究的成果可以用于BRFDs的设计,并展现出生物吸收血管内设备的一些优势。与传统的永久性FD相比,BRFDs的潜在优势包括:
1. 降低急性和慢性支架诱发的血栓形成风险:许多生物可吸收材料的表面特性较常规材料更少诱发血栓,从而降低急性设备血栓风险。
2. 减少慢性炎症、新生内膜增生,最终降低狭窄风险:与生物吸收冠状动脉支架类似,BRFDs的暂时性可以减少植入物引起的长期生物反应。
3. 减少侧支分支闭塞:FD导致的侧支分支闭塞事件在长期内持续存在,而BRFDs逐渐最终完全吸收的特性可能会减少晚期(>1年)的侧支分支闭塞。
4. 恢复生理性血管运动:临床研究表明,可生物吸收的冠状动脉支架在吸收后恢复了血管的运动功能[18]。
5. 减少影像伪影:随访CT或MRI用于评估FD性能。许多生物可吸收材料的固有特性相较于常规FD材料能减少影像伪影。此外,支架体积的逐渐减少进一步表明随着时间推移伪影也会减少。
6. 适用于儿科:BRFDs的暂时性特性不会干扰患者及其血管的生长。尽管FDs用于儿科动脉瘤的治疗不常见,但已有许多案例研究存在[19]。
基于这些潜在优势,许多研究小组已开始制造和测试用于IAs治疗的可生物吸收设备,近年来相关的文献数量大幅增加。受限于篇幅,这一块的内容就不展开了,有机会希望可以单独写一次BRFDs的内容。
尽管数据有限,仍有多个研究报告了在表面修饰血流导向装置应用于动脉瘤治疗中使用单一抗血小板治疗的尝试。Guzzardi及其同事在一项包含7例破裂动脉瘤的系列研究中,使用阿司匹林单抗治疗和Phenox HPC装置治疗,未见支架内血栓形成。然而,在另一项使用阿司匹林单抗治疗治疗未破裂动脉瘤的前瞻性研究中,7例患者中有3例出现了缺血性并发症,导致研究停止[15]。Hanel及其同事首次报道在使用PED Shield技术治疗一例破裂的椎动脉梭形动脉瘤时使用阿司匹林单抗治疗,但术后第10天观察到临床无关的支架内血栓形成[17]。最后,澳大利亚的一项研究报告了在急性蛛网膜下腔出血的情况下应用PED Shield技术且未使用双重抗血小板疗法的情况。在14例患者中,1例发生了完全支架内血栓形成,另1例患者因动脉瘤再次出血死亡[17]。这些临床系列的混合结果表明,在使用表面修饰的血流导向装置时单一抗血小板治疗时还需要谨慎。
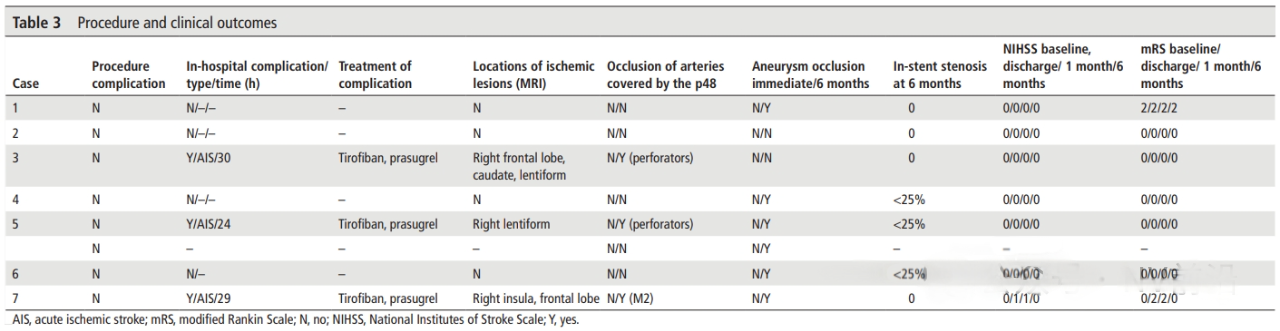
(Aspirin monotherapy in the treatment of distal intracranial aneurysms with a surface modified flow
diverter: a pilot study)
2024有源医疗器械创新论坛认为,血流导向已成为现代血管内动脉瘤治疗的支柱。多种分子表面修饰技术已被引入,以降低支架的血栓形成性,并减少对双重抗血小板疗法的依赖。目前关于涂层支架的安全性和有效性尚缺乏大样本研究,已报道的几项单中心小队列研究(通常<50例)显示涂层支架联合单抗治疗术后缺血并发症与裸支架双抗治疗相当。这些研究提示使用涂层密网支架联合单个抗血小板药物治疗可能是可行的,且能改善术后长期双抗带来的出血并发症问题,但仍需要进一步的研究证据。
*参考文献:
[1]. Gruntzig A. Trans-luminal dilatation of coronary-artery stenosis. Lancet 1978;1:263.
[2]. Sigwart U, Puel J, Mirkovitch V, Joffre F, Kappenberger L. Intravascular stents to prevent occlusion and restenosis after transluminal angioplasty. N Engl J Med 1987;316:701–706.
[3]. Morice M, Serruys PW, Sousa JE. A randomized comparison of a sirolimus-eluting stent with a standard stent for coronary revascularization. N Engl J Med 2002;346:1773–1780.
[4]. Joner M, Finn AV, Farb A. Pathology of drug-eluting stents in humans—Delayed healing and late thrombotic risk. J Am Coll Cardiol 2006;48:193–202.
[5]. Xiang Peng, Wenbo Qu. Bioresorbable Scaffolds: Contemporary Status and Future Directions. Front Cardiovasc Med,2020 Nov 30:7:589571.
[6]. Cagnazzo F, di Carlo DT, Cappucci M, et al. Acutely ruptured intracranial aneurysms treated with flowdiverter stents: a systematic review and meta-analysis. AJNR Am J Neuroradiol 2018;39:1669–75.
[7]. Feroze Nazneen,1 Gregoire Herzog. Surface chemical and physical modification in stent technology for the treatment of coronary artery disease. Published online 30 July 2012 in Wiley Online Library (wileyonlinelibrary.com). DOI: 10.1002/jbm.b.32772.
[8]. Harder C, Rzany A, Schaldach M. Coating of vascular stents with antithrombogenic amorphous silicon carbide. Prog Biomed Res 1999;4:71–77.
[9]. Heublein B, Pethig K, Elsayed A. Silicon carbide coating—A semiconducting hybrid design of coronary stents—A feasibility study. J Invasive Cardiol 1998;10:255–262.
[10]. Justin E. Vranic, MD, Pablo Harker, MD. The Impact of Dual Antiplatelet Therapy Duration on Unruptured Aneurysm Occlusion After Flow Diversion: A Multicenter Study. J Comput Assist Tomogr • Volume 47, Number 5, September/October 2023.
[11]. Girdhar G, Ubl S, Jahanbekam R, et al. Thrombogenicity assessment of pipeline, pipeline shield, Derivo and P64 flow diverters in an in vitro pulsatile flow human blood loop model. eNeurologicalSci 2019;14: 77–84.
[12]. Taschner C, Stracke CP, Dorn F, et al. Derivo embolization device in the treatment of unruptured intracranial aneurysms: a prospective multi center study. J Neurointerv Surg 2021;13(6):541–6.
[13]. Pierot L, Soize S, Cappucci M, et al. Surface-modified flow diverter p48-MW-HPC:preliminary clinical experience in 28 patients treated with two centers. J Neuroradiol 2021;48(3):195–9.
[14]. Rawad Abbas, MD, Matthews Lan, MD. First United States multicenter experience with the new-generation FRED X surface-modified flow diversion stent: feasibility, safety, and short-term efficacy. J Neurosurg October 6, 2023.
[15]. De Castro-Alfonso LH, Nakiri GS, Abud TG, et al. Aspirin monotherpay in the treatment of distal intracranial aneurysms with a surface modified flow diverter: a pilot study. J Neurointerv Surg 2021; 13(4):336–41.
[16]. Hanel RA, Aguilar-Salinas P, Brasiliense LB, et al. First US experience with pipeline flex with shield technology using aspirin as antiplatlet monotherapy. BMJ Case Rep 2017;2017. bcr2017219406.
[17]. Manning NW, Cheung A, Phillips TJ, et al. Pipeline shield with single antiplatlet therapy in aneurysmal subarachnoid hemorrhage: multicenter experience. J Neurointerv Surg 2019;11(7):694–8.
[18]. Garcia-Garcia HM, Haude M, Kuku K, et al. In vivo serial invasive imaging of the second-generation drug-eluting absorbable metal scaffold (Magmaris – DREAMS 2G) in de novo coronary lesions: Insights from the BIOSOLVE-II First-In-Man Trial. Int J Cardiol 2018;255:22–8.
[19]. Barburoglu M, Arat A. Flow diverters in the treatment of pediatric cerebrovascular diseases. AJNR Am J Neuroradiol 2017;38:113–8.
文章来源: NV前沿