2025上海医疗器械创新展HIFU 组织消融术:概念和设备
2024-11-21
高强度聚焦超声 (HIFU) 是用于描述高功率超声聚焦束用于治疗效果的术语。该技术有时也称为聚焦超声手术 (FUS)。2025上海医疗器械创新展了解到,现在许多不同的 HIFU 治疗的共同特征是需要提供一个光束,其中能量足以仅在病灶体积内产生生物变化。除了少数例外,其目的是诱导不可逆的损伤,尽管在某些应用中,例如药物输送,目标是产生更多的瞬态效应。
2. HIFU 的原理
超声波在0.8-5 MHz频率下波长2-0.3毫米,能在焦平面形成高压区。能量足够时,可在该区产生显著温升,其他区温升可忽略。2025上海医疗器械创新展认为类似放大镜聚光点火,HIFU技术能将焦点温度升至>56°C致热坏死,其他区域温度保持原状。图1展示原理、病变外观及组织学切片,显示活死细胞分界明显。
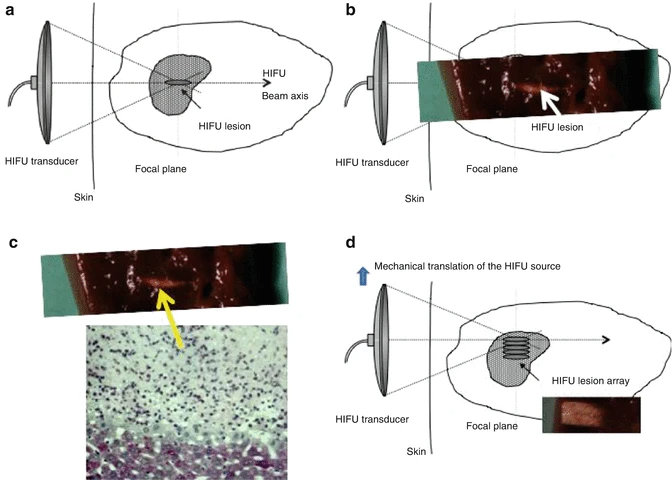
HIFU 的历史
高强度聚焦光束(HIFU)的概念于1942年首次提出,旨在探索多种医疗应用。1940-1950年代,研究者尝试通过选择性破坏大脑区域来增进对神经行为的理解。尽管早期研究受限于超声图像质量和需要开颅手术,但成功实现了对实验动物大脑特定区域的选择性破坏,并进行了帕金森病的人类治疗。HIFU的发展与L-dopa药物的推出相吻合,后者成为更受欢迎的帕金森病治疗方法。
直到1990年代,HIFU在眼科治疗中才获得认可,尽管1952年Lavine等人就提出其在眼科的应用。研究显示HIFU能降低眼压并产生眼部病变。1982年首次用于青光眼治疗,79%患者在1年后眼压降低。尽管前景广阔,激光手术因技术简单更受欢迎。近年来,HIFU在青光眼治疗中重新受到关注并取得成功(Aptel等,2014)。
临床使用概述
现代超声和MRI技术使HIFU治疗更精确,实现良好随访。这些技术提供实时图像,有助于精确定位治疗区域。MRI提供解剖和温度成像,而超声则具有高空间和时间分辨率。两者都用于HIFU治疗的指导和监测,各有优势。HIFU已成功用于治疗肝脏、肾脏、乳腺、胰腺恶性肿瘤和骨肉瘤,以及缓解骨肿瘤引起的疼痛。需注意避免肠道气体干扰。HIFU也是治疗子宫肌瘤的有效技术,可在MR或超声图像上清晰显示。
前列腺肿瘤的HIFU治疗已广泛研究,针对BPH和前列腺癌。BPH的初步临床试验显示流速增加和残余尿量减少,但长期效果不佳,44%患者需TURP。HIFU治疗前列腺癌面临不同挑战,如病灶难以检测。最初旨在消融整个腺体,现趋向部分消融。HIFU对放疗后复发的前列腺癌患者可能有效,早期试验结果积极。
有源医疗设备展Medtec现场将设四大专区,囊括电子光学、AI、IVD诊断及影像、检测、临床、法规、研发设计& 大动物实验专区等展品,点击此处报名参展>>>
4 暴露剂量测定
在电离辐射成像和治疗中,“暴露”(单位:伦琴,R)与“剂量”(单位:格雷,Gy)有别。暴露量描述辐射量,而剂量表征每公斤组织吸收的能量。不同辐射的生物效应通过相对生物效应(RBE)比较,形成“剂量当量”(单位:rem或Sv)。X射线、γ射线和β粒子的RBE为1.0,α粒子为20。在医学超声中,“暴露”和“剂量”可互换使用,但超声能量传递模式影响生物效应。例如,连续模式与脉冲模式对组织的热效应和空化活性不同。超声暴露根据水中自由场条件下的声场表征,HIFU暴露需考虑频率、时间、换能器特性、功率、声压/强度和能量传递模式。实现超声场中从暴露到剂量的过渡需了解介质的声学特性,如衰减、吸收系数、声速和非线性参数B/A。HIFU暴露通常基于自由场水测量描述,有时通过估计总衰减计算原位强度。热剂量参数用于描述癌症热疗治疗,将特定组织体积的温度-时间历史积分并简化为43°C时的生物等效暴露时间。临床上,t43240分钟为热消融成功阈值。空化可增强HIFU加热,但缺乏量化方法和定义。
5 HIFU 治疗交付
临床上用于输送 HIFU 的设备大致分为两类,体外和间质。然而,基本组件并没有太大区别,包括换能器、信号发生器、放大器、最大化电声效率的匹配电路、功率计,以及在某些情况下冷却换能器的方法。这些传感器连接到操作员控制台,允许移动和定位源,并且还提供了一种监测处理的方法。
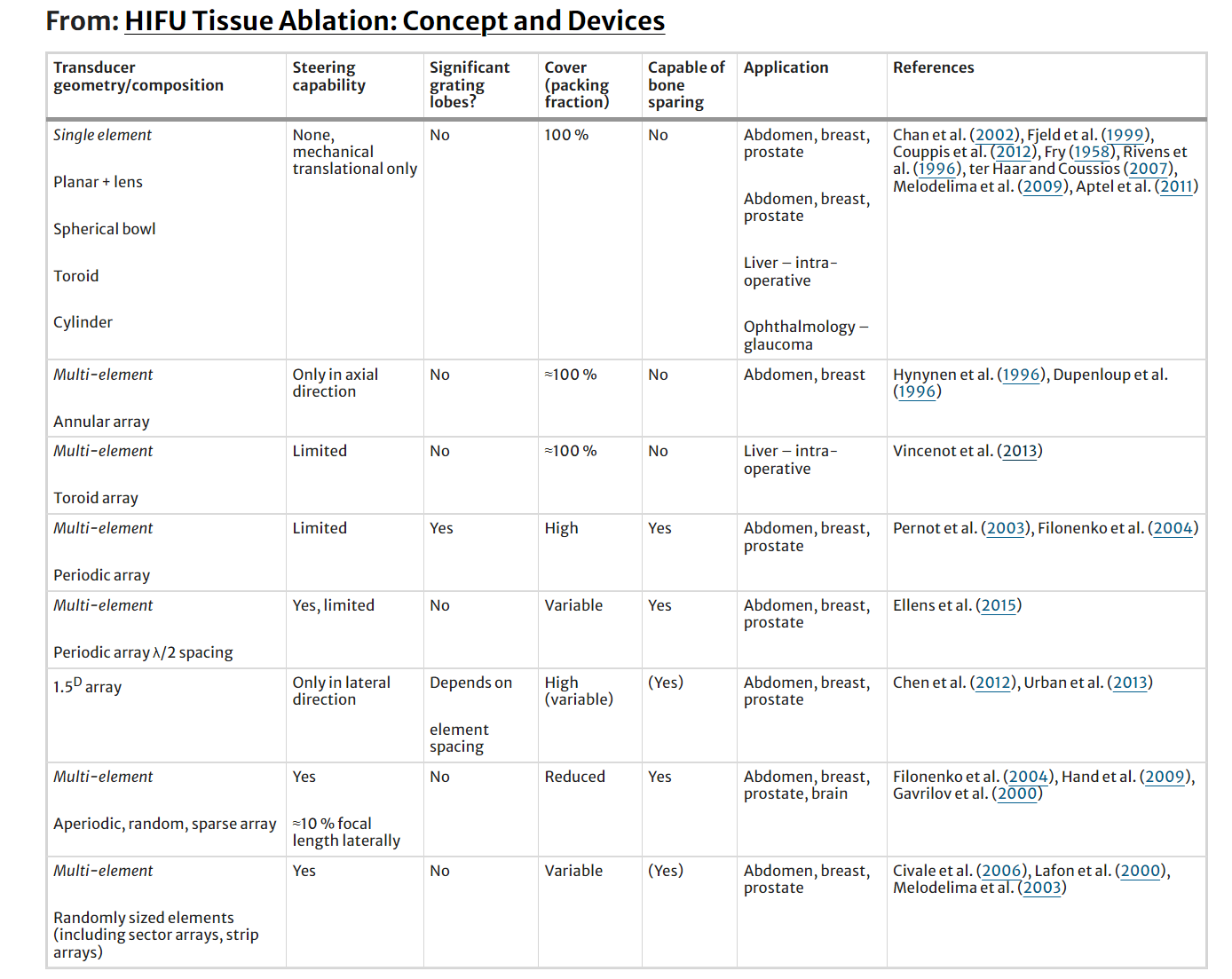
HIFU治疗的聚焦可通过单晶探头(平面圆盘或球形碗)实现,但需物理移动以覆盖不同病灶。更常见的是使用多晶片换能器阵列,通过电子定相实现焦点的灵活塑造和动态控制。阵列的几何形状影响功能,如同心元件(环形阵列)可沿光束轴电子移动焦点。
当单个晶片置于球壳上,可通过探头几何、相位和波幅控制实现聚焦。为确保HIFU安全,需最小化栅瓣,避免非目标区域组织局部加热。多种方法通过破坏元素间距的规则性、引入随机性和稀疏性来减少栅瓣。随机阵列可横向移动焦距约10%。Pernot等人比较了三种稀疏阵列在0.9MHz频率下的旁瓣转向能力,发现准随机设计最佳。图1.2-1.4展示了256单元随机阵列的场模拟,显示单元数量、碗曲率半径和驱动频率对波束方向图的影响。
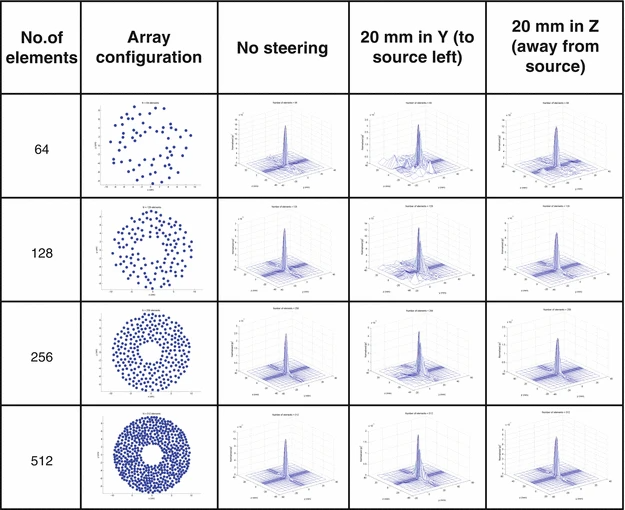
更改元素数量的影响。曲率半径 20 cm,直径 20 cm,频率 1.7 MHz,中心孔径直径 5 cm
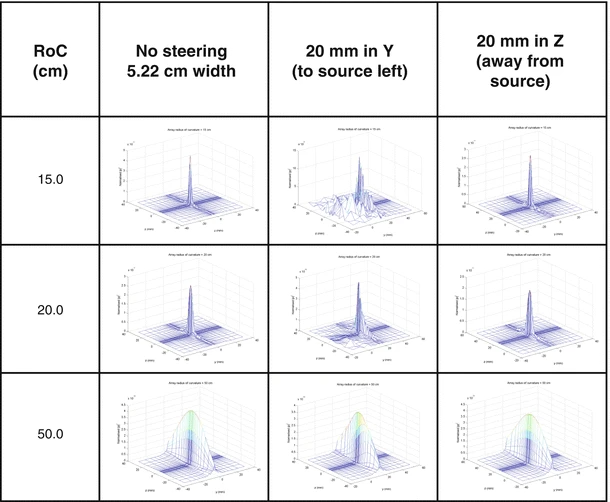
曲率半径 (RoC) 变化的影响。256 个元件,直径 20 cm,频率 1.7 MHz,中心孔径直径 5 cm
全尺寸图像
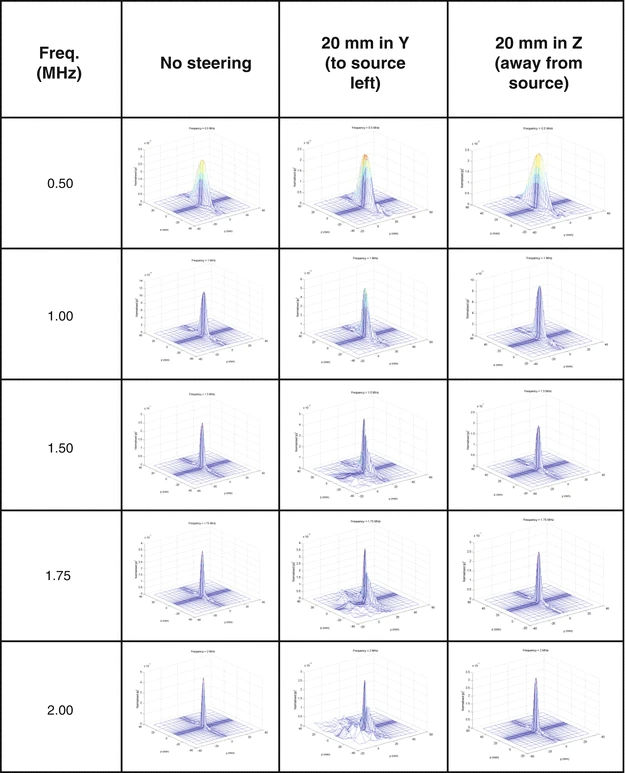
频率变化的影响。256 个元件,曲率半径 20 cm,直径 20 cm,中心孔径直径 5 cm
稀疏阵列的一个缺点是能量在近场中不相干地沉积,导致低水平加热。当多个焦点性病变并排放置且近场重叠时,温度可能升至生物学意义的水平。为避免此问题,可在“注射”间引入冷却时间,但这会延长治疗时间。为减少这些问题,提出了一种500 kHz的平面相控阵,其元件间距为λ/2。虽然这降低了近场加热的影响并避免了栅瓣问题,但较低的频率会导致较低的空间分辨率和空化阈值,并增加焦距后加热的可能性。在这个频率下,超声波吸收降低,需要更多的声功率来达到所需温度。所有设计都需要权衡和妥协。
当治疗胸腔后或颅骨下的靶区时,需避免骨表面过热。对于胸腔,可使用光线追踪或时间反转、自适应聚焦技术来靶向骨骼后的区域,这些技术已成功用于治疗神经系统问题。颅骨引起的超声失真可通过时间反转技术校正,结合振幅校正恢复大脑目标焦点。虽然植入传感器不现实,但可通过MR或CT图像模拟颅骨超声特性进行波前畸变建模。这允许虚拟点源波前通过颅骨传播并被外部接收器记录,实现振幅校正后聚焦光束指向大脑目标。
5,1 传感器材料
在设计治疗超声换能器时,需考虑多个限制因素。换能器必须在0.25-10 MHz频率范围内产生高功率,具有高电声转换效率,可靠性强,并能以脉冲或连续波形式传递能量。它们还需与成像方法兼容,特别是与MR引导的HIFU期间的高磁场兼容,这是一个技术挑战。当超声是首选监测方式时,治疗换能器通常需要一个中心孔以插入成像探头。目前,对双模式换能器元件的需求日益增长,即既能作为高功率治疗源运行,又能在短脉冲成像模式下使用。
多元素数组通常以以下两种方式之一构造。单个元件可以装在单独的外壳中,然后单独安装在所需几何形状的外壳上。这允许轻松替换失败的元素,并为其排列提供灵活性,但只允许稀疏数组。这种多元素数组的一个例子如图 2 所示。1.5. 另一种方法是创建一个阵列,例如,将深槽切割成单个压电陶瓷片。这允许更密集的元素打包,但在需要更大尺寸时可能会创建脆弱的数组。这两种方法的混合组合也是可能的。

由 256 个单独的元件组成的多元件伪随机阵列,安装在 3D打印外壳中
全尺寸图像
医用超声换能器通常由压电材料制成,早期使用石英。压电现象由Curie兄弟于1880年代发现,指晶体在受力时产生电荷。交流电作用于压电盘产生压力波。除石英外,其他天然压电材料包括蔗糖、电气石等。医学超声中常用的压电材料是锆钛酸铅(PZT),其厚度决定谐振频率。高功率应用中,PZT传感器采用空气背衬以冷却并减少阻尼。高密度阵列易产生串扰,而压电复合结构可减少此问题。治疗超声中常见的压电复合材料几何形状为1-3型。聚偏二氟乙烯(PVDF)也是医疗超声中常用的压电材料,可制成薄膜并作为传感器或低功率源。CMUT曾被认为不适合HIFU应用,但最新研究表明这一限制可被克服。
6 临床设备
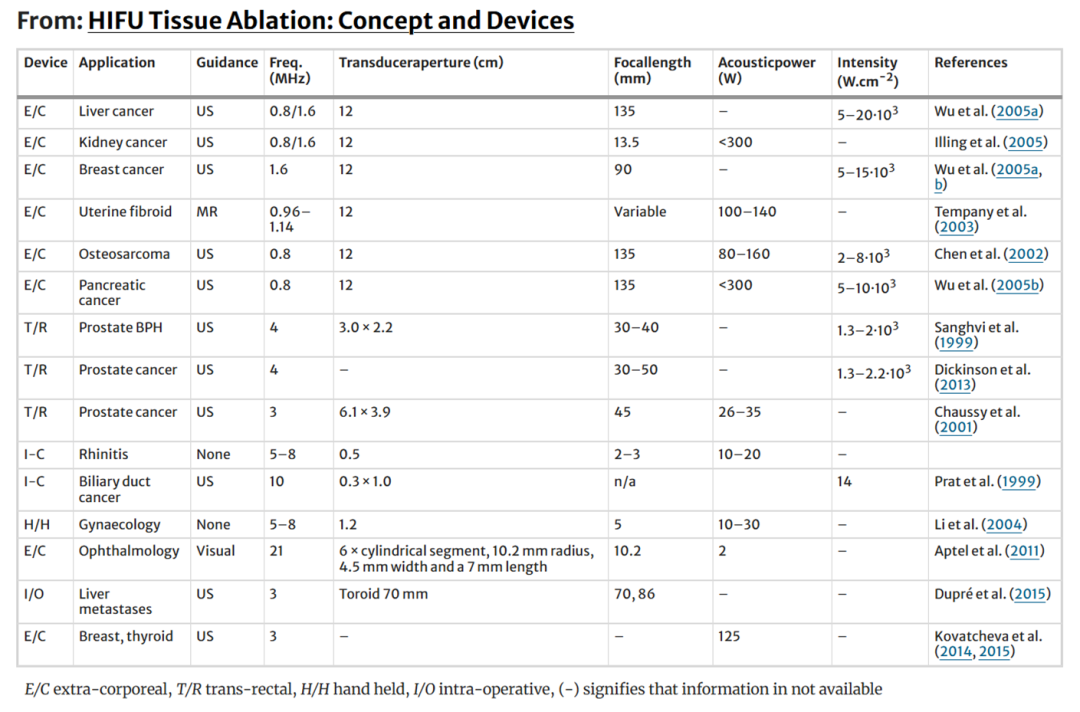
目前临床使用的传感器特性如表 1.2 所示。这不一定是一个完全全面的列表。大多数系统的目标是在聚焦处提供大于 103 W.cm−2 的原位强度。对于长焦距的体外光源,这是使用高功率大孔径光源实现的。大孔径光源的优点是将入射能量分布在较大的皮肤区域,从而减少皮肤灼伤的可能性。经直肠和腔内源以较低的功率和较高的频率运行,因为它们可以放置在靠近目标体积的位置。
6,1 体外装置
位于乳房、腹部、大脑或四肢内的组织靶标通常使用体外 HIFU 源进行治疗。这需要在皮肤上有一个合适的声学窗口,以允许进入传播路径中没有气体或骨骼的治疗部位。还必须能够使用耦合凝胶、水球或其他与皮肤声阻抗相似的材料的合适路径将超声波能量耦合到皮肤表面。体外 HIFU 治疗使用 US 或 MRI 指导。Rivens 等人 (2007) 已经审查了这些方法。在 MR 引导下进行治疗时,必须注意治疗头的磁相容性。PZT 含有镍,有助于引起高水平的电激励和机械应力。镍会导致磁场失真,当传感器涂有导电银涂层时,可能会产生涡流。这些涡流可能会导致局部磁场不均匀,并产生明显的图像伪影。通过将传感器表面划分为多个区域,可以减少这些电流(Wharton 等人,2007 年)。上面讨论的压电复合材料减少了这些问题,并已被现在可用的商业临床系统使用。
MR 引导的优势在于,可以使用测温序列,允许在软组织中进行温度映射。这使得温度或计算的热剂量可以叠加在解剖 MR 图像上。使用这种类型的显示,可以在治疗过程中 “绘制 ”整个目标区域。两种最常用的 MR 引导临床 HIFU 系统以不同的方式实现体积消融。这两个系统都旨在最大限度地减少治疗时间。在一种情况下,焦点以电子方式以同心圆扫描,用户可以选择此扫描的最大直径,而在另一种情况下,应用于多元件阵列的相位和振幅设计为在焦平面上产生多个焦峰值。
当 US 用于指导和监测 HIFU 治疗时,诊断换能器被整合到治疗头中。这允许对消融过程进行实时成像。在没有造影剂介质的情况下,热烧蚀区域在标准 B 型图像上不可见,除非已诱导气泡。因此,通常会调整 HIFU 暴露水平,直到在美国图像上看到高回声区域,这表明该区域存在气泡。这些气体是通过组织气体的热溶解产生的。消融过程会改变组织的刚度,因此弹性成像技术应该允许实时监测治疗,尽管该技术尚未实现广泛的临床应用。
6,2 经直肠装置
经直肠装置已被开发用于治疗良性和恶性前列腺疾病。这些探头可以按直肠插入,并将成像和治疗换能器集成在一个单元中。由于经直肠超声成像 (TRUS) 是许多泌尿科医生的首选诊断检查,因此这些设备的临床接受度更高。有两种市售设备,它们在概念上非常相似。在这两个系统中,治疗换能器都采用截断的球形碗的形式。
6,3 间质设备
人们对开发高强度超声探头用于间质治疗表现出兴趣。这些传感器通常采用平面而非聚焦元件,通过旋转探头实现体积破坏。Prat等(1999)设计了一种胆道肿瘤导管内治疗探针,配备3×10mm的10MHz平面传感器,安装在不锈钢轴上,可透视引导定位。换能器表面超声强度为14W/cm²,脉冲持续10-20秒。通过旋转柔性探针实现圆周消融,每次“射击”后旋转18°,直至形成360°损伤环。该技术已在临床应用并取得积极结果(Prat等,2001)。基于类似原理的MR兼容设备也已开发用于食管肿瘤治疗(Melodelima等,2005)。尽管前列腺HIFU治疗的主要途径是经直肠,但也探索了经尿道途径以降低直肠壁损伤风险(Sommers等,2013;Siddiqui等,2010)。
7 总结
2025上海医疗器械创新展认为,现代医学追求最小干预和住院时间的个性化治疗,HIFU作为微创癌症治疗技术,正迅速获得认可。它是最不侵入性的消融技术,但存在技术和治疗交付问题需解决。多晶片相控阵源提高HIFU灵活性和缩短治疗时间,整合治疗和诊断技术提升安全性和有效性。随着临床证据增加,HIFU有望发展更多特定应用设备。
文章来源;











