分子诊断领域又一奔涌的后浪——数字PCR
2020-10-28
01 背景介绍
自2019年底新型冠状病毒肺炎爆发以来,分子诊断技术在新型冠状病毒(SARS-CoV-2)的检测方面做出了非常重大的贡献。分子诊断技术除了实时荧光定量PCR(qPCR)之外,还包括新一代高通量测序(NGS),核酸质谱,毛细管电泳(CE),CRISPR检测技术,分子POCT,恒温扩增(LAMP)以及数字PCR(dPCR)等。
数字PCR是一种新的核酸检测和定量方法,与传统定量PCR技术不同,数字PCR采用绝对定量的方式,不依赖于标准曲线与标准品,直接检测目标序列的拷贝数。由于这种检测方式具有比传统qPCR更加出色的灵敏度、特异性以及精确性,dPCR近年来的应用越来越广泛,发展也越来越迅猛。
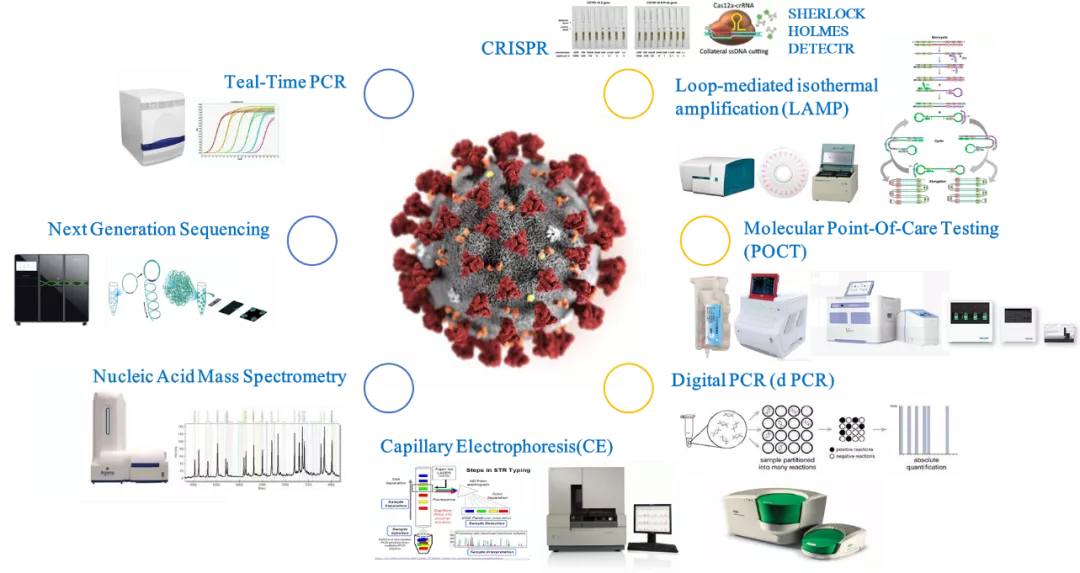 分子诊断技术(图片来源于网络)
分子诊断技术(图片来源于网络)
02 数字PCR的发展历史
源起&原理
数字PCR的概念于1999年由Vogelsteinc等提出,这种技术采用的策略可简单地概括为“分而治之”(divide and conquer),类似于计算机科学中的“分治算法”,核心思想是将一个标准的PCR反应体系分配到大量(数万至数百万)微小的反应单元中,每个反应单元中包含或不包含一个或多个拷贝的靶标分子(模板) ,实现“单分子模板PCR扩增”,扩增结束后,通过阳性反应单元的数目统计出靶标分子的拷贝数。在实际的数字PCR实验中,事实上是通过呈现两种信号类型的反应单元比例及数目进行统计学分析,根据泊松分布原理校正计算出原始样本中的模板拷贝数。
发展及局限
早期的数字PCR尝试采用96孔板或384孔板甚至1536孔板作为分隔反应体系的载体。后期数字PCR先后经历了乳液PCR,BioMark Fluidigm的腔式芯片,Life Technologies的12k芯片等等一系列的改进与发展,但这些方法无论在分散程度还是大数据群体的体量上都无法达到更加精细的要求,时间与耗材成本也是限制数字PCR发展的两大障碍。
商业化进程
直到2010年Bio-Rad微滴式数字PCR的发布,数字PCR才开始真正意义上的商业化应用,同时也为Bio-Rad在数字PCR领域占据压倒性的市场优势奠定了坚实的基础。两年后Life Technologies公司(已于2013年被Thermo Fisher收购)也迅速推出芯片式数字PCR系统,开启了芯片式数字PCR的新方向。此后由科学奇才Jonathan Rothberg的团队创立的RainDance公司(已于2017年被Bio-Rad收购)推出微滴数可达百万以上的Raindrop系统,将分散相的分隔单元数提升到新的数量级。2015年新加坡的JN Medsys公司推出Clarity数字PCR系统,巧妙地设计出了在传统PCR管中反应和检测的芯片。2016年法国的Stilla公司推出了结合微滴与芯片的新型数字PCR系统,为数字PCR的发展提供了新的思路。
现状
近年来,数字PCR的发展与竞争越来越趋于白热化,Illumina、Roche及Qiagen也已纷纷布局。近年来国内也有大量玩家纷纷角逐于数字PCR的战场,这其中有泛生子、永诺生物、科维斯、诺禾致源、小海龟、锐讯生物、斯纳福、领航基因、卡尤迪以及新羿生物等等。国内的玩家在开发模式上不乏有自主开发、OEM国外品牌(贴牌Life Technologies公司芯片式数字PCR为主)以及合作开发等。
图示
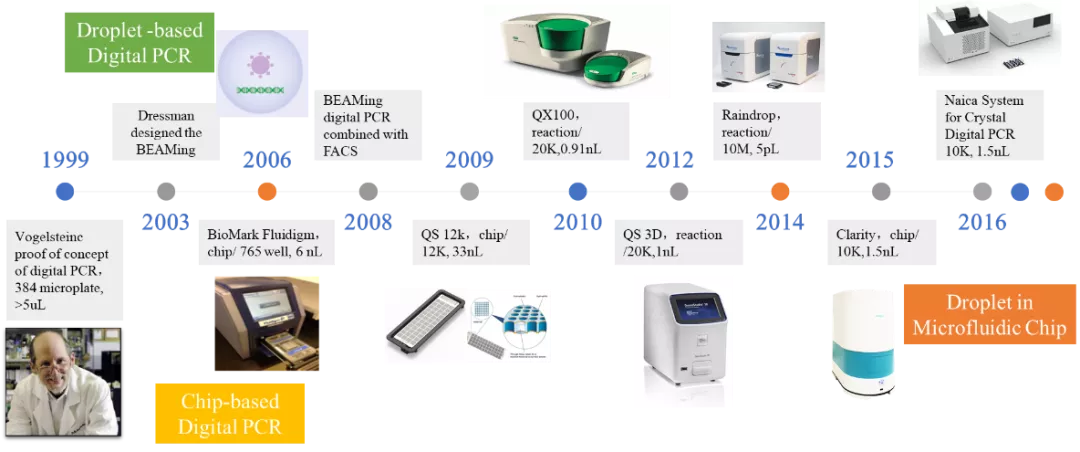 数字PCR的发展历史 03 数字PCR的原理与优势
数字PCR的发展历史 03 数字PCR的原理与优势
数字PCR的生化原理与实时荧光定量PCR并无明显的差异。PCR产物的鉴别均基于荧光信号的读取,不论是水解探针(例如TaqMan 探针)法还是DNA结合探针法(如SYBR Green I)均与实时荧光定量PCR类似。
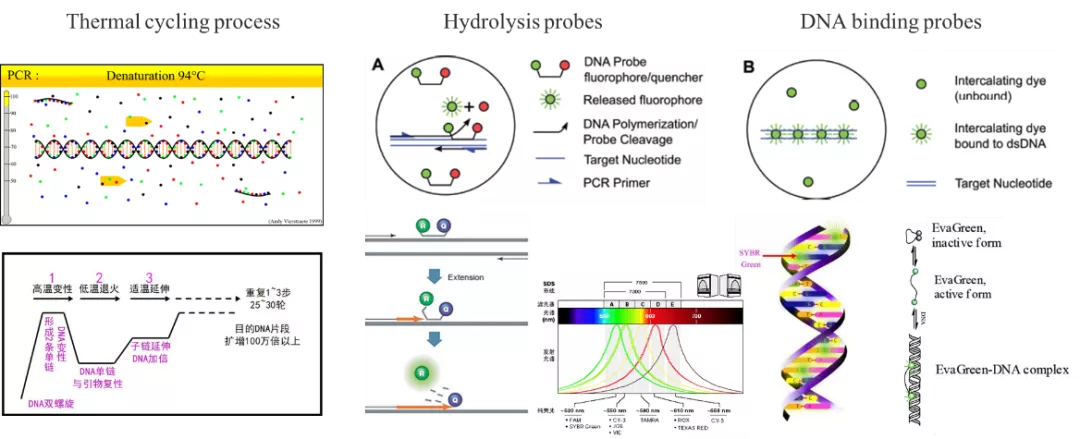 PCR过程与荧光探针
PCR过程与荧光探针
水解探针法是在PCR扩增时同时加入一对引物和一条特异性的荧光探针(如Taqman探针),该探针与模板特异性地结合,其结合位点在两条引物之间,当探针完整时,报告荧光基团和淬灭荧光基团的空间距离很近,报告荧光基团发射的荧光信号会被淬灭基团淬灭,使仪器检测不到荧光信号。PCR扩增时,Taq酶的5'-3'外切酶活性将探针酶切降解,使报告荧光基团和淬灭基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。
Taqman探针的荧光基团通常设计在5’端,主要有荧光素类,罗丹明类以及菁系列染料;淬灭基团通常设计在探针的3’端,以BHQ系列基团为主。在水解探针的设计上,为了提高探针的Tm值与特异性,还可以在探针的3’端修饰MGB(小沟结合物)基团或在探针中嵌入LNA(锁核酸)碱基等。
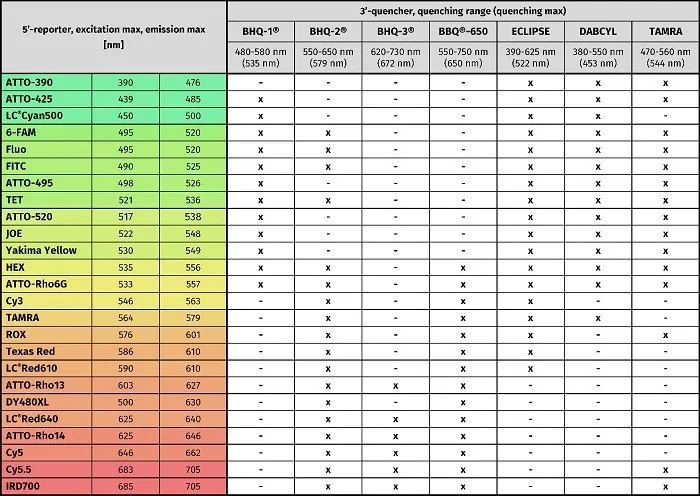 水解探针常用荧光基团与淬灭基团(图表来源于Jena Bioscience官网)
水解探针常用荧光基团与淬灭基团(图表来源于Jena Bioscience官网)
DNA结合探针法(荧光染料法)是在PCR反应体系中,加入过量荧光染料,该染料仅与双链DNA小沟结合,并不与单链DNA链结合,而且在游离状态不发出荧光,只有掺入DNA双链中才可以发光,因此,在PCR体系中,随着特异性PCR产物的指数扩增,每个循环的延伸阶段,染料掺入双链DNA中,其荧光信号强度与PCR产物的数量呈正相关。常用的结合探针染料包括SYBR GreenⅠ,EvaGreen及SolisGreen等。
数字PCR与实时荧光定量PCR的技术原理区别在于数字PCR是将一个实时荧光定量PCR反应体系有限稀释到上万个单元或分区,实现“单分子扩增”。在数字PCR中,以“终点信号的有或无”(all-or-none end point)作为判断标志,往往在读取与分析荧光信号时,设定一个阈值,信号高于阈值的阳性反应记为“1”,低于阈值的阴性反应记为“0”,最后统计“1”和“0”的个数以实现绝对定量,这也是数字PCR(digital PCR)名称的由来。
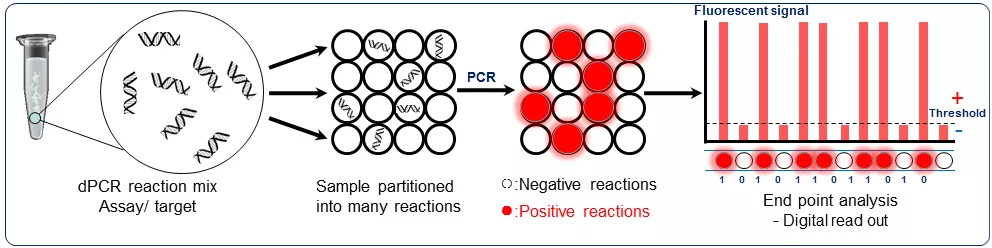 数字PCR技术原理
数字PCR技术原理
数字PCR是如何实现绝对定量的呢?
荧光强度低于阈值的“阴性”反应可以确定其中不存在靶标分子,但是对于荧光强度高于阈值的“阳性”反应,该反应单元中可能存在一个、两个甚至更多个拷贝的靶序列。那么,直接将“阳性”反应的数量作为靶标分子的拷贝数,肯定会带来定量误差。因此在计算靶标分子的拷贝数时,需要将“阳性”反应单元中存在不止一个靶标分子的情况考虑在内。若将“阳性”反应单元中出现各种靶标拷贝数(1, 2,…)的概率计算出来,就可以通过概率分布的期望计算出每个“阳性”反应平均代表了多少个靶标分子,进而将阳性反应单元的数量折算成靶标分子的拷贝数。
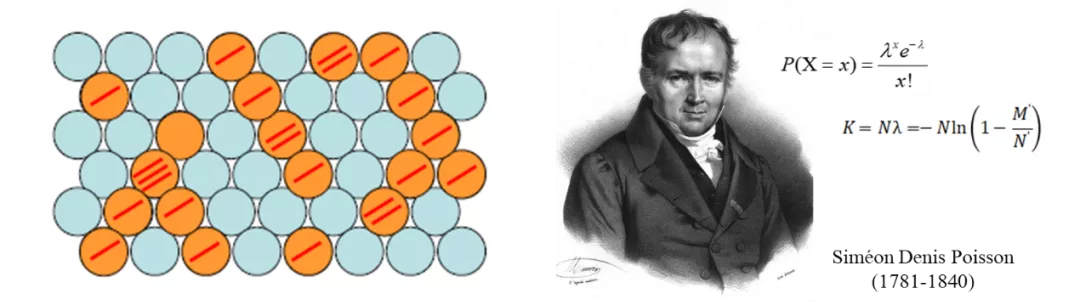 泊松分布
泊松分布
对于数字PCR,设微反应单元总数为N,投入的靶标分子的拷贝数为M,那么“每个反应单元中的靶标分子拷贝数”的概率分布在反应单元足够多的条件下近似满足泊松分布。因此,可以利用泊松分布,以及实验获得的“阳性”反应单元数M',计算出投入了多少靶标分子的拷贝数(M)
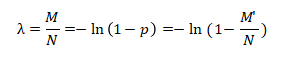 投入的DNA模板数目(M)可以进一步推导得到
投入的DNA模板数目(M)可以进一步推导得到
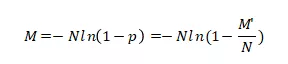 从而实现对核酸分子的绝对定量。
从而实现对核酸分子的绝对定量。
数字PCR技术具备可绝对定量、精准度好、灵敏度高及抗抑制剂能力强等优势。其中可绝对定量如前所述;精准度好主要体现在可重复性,同时无需标准曲线的绘制,也无需标准品,统计分析过程中引入泊松统计,大大提高了精准度;抗抑制剂能力强是由于样本被稀释后,PCR抑制剂也被相应地稀释,随着反应单元数的增加,反应受到抑制剂的影响就越小;灵敏度可达到单个核酸分子,检测限低至0.001%,远远低于实时荧光定量PCR与NGS检的检测限。
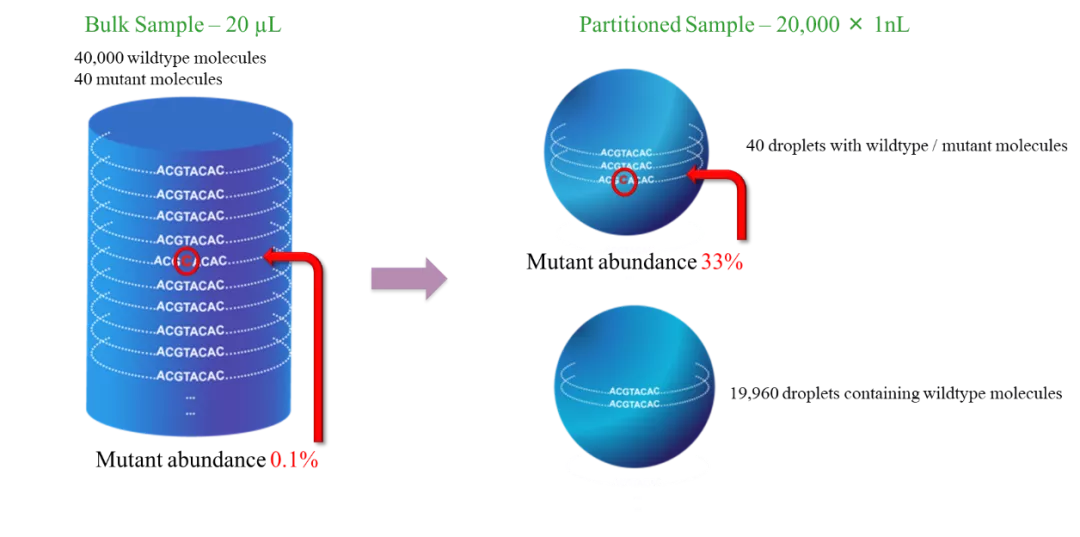 数字PCR检测灵敏度的提高
数字PCR检测灵敏度的提高
04 数字PCR的分类
数字PCR是利用微流控技术或芯片快速并准确地将样品反应液分隔成成千上万个独立单元,后续再进行多步平行反应。
数字PCR的独立单元分区主要有三种策略:一种是采用油包水的方式将PCR反应液包进微滴中实现微滴的隔离,这种称为微滴式数字PCR(droplet digital PCR, ddPCR);另一种是基于芯片式微流控的微阵列芯片式数字PCR(chip digital PCR, cdPCR),利用芯片的微孔或微管将反应液隔离;此外还有一种策略是结合微滴与芯片的方式将反应液分隔成大量独立的分区。无论哪一种数字PCR,其原理的底层的逻辑均为有限稀释,终点PCR以及泊松分布校正定量。
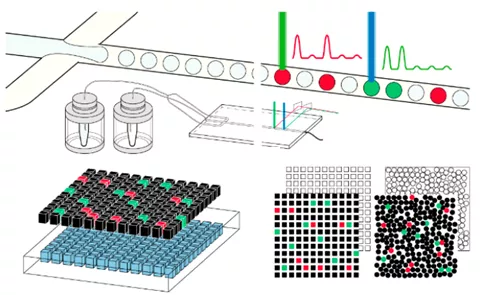 数字PCR分散相的分隔策略
数字PCR分散相的分隔策略
壹 微滴式数字PCR以Bio-Rad公司的QX100系统、QX200系统以及Raindance公司的Raindrop系统为代表。其微滴分区方式是将两种互不相溶的液体,以其中一种作为连续相(油相),另一种作为分散相(水相,即PCR反应液),在水/油两相表面张力和剪切共同作用下分散相以微小体积单元的形式存在于连续中,从而成液滴。这种液滴式的反应腔室具有体积小、样品间无扩散等优势。
在ddPCR中,利用微滴发生器可以一次生成数万乃至百万个nL甚至pL级别的单个油包水微滴,作为数字 PCR 的样品分散载体。这里,液滴中包裹了单拷贝DNA模板和PCR反应液,然后将液滴收集在PCR反应管中进行扩增。PCR反应结束后单独检测每个微滴的荧光信号。
Bio-Rad公司的数字PCR系统中主要以氟化油作为油相,在水相中除了PCR反应体系外,还额外添加了一种特殊的表面活性剂用以稳定乳液微滴,防止在微滴在转移,升降温以及检测过程中的融合或破乳。
Raindance系统反应单元分隔方式与Bio-Rad公司类似,其特点是微滴数可提升至百万甚至千万级别。
 贰 微阵列芯片式数字PCR主要通过芯片设计将PCR反应液封闭在高通量的微池或微量通道中进行后续的PCR扩增,扩增后采用荧光成像直接判读。其芯片特点是反应位点(微池或微量通道)的表面均是亲水的,非反应位点可修饰成疏水表面。样品(即PCR反应液)在涂布上样时通过毛细管作用将水相加载并保持在位点中,上样结束后再将芯片浸没在油相(矿物油或PDMS)中,以防止在热循环过程中水分的挥发。
贰 微阵列芯片式数字PCR主要通过芯片设计将PCR反应液封闭在高通量的微池或微量通道中进行后续的PCR扩增,扩增后采用荧光成像直接判读。其芯片特点是反应位点(微池或微量通道)的表面均是亲水的,非反应位点可修饰成疏水表面。样品(即PCR反应液)在涂布上样时通过毛细管作用将水相加载并保持在位点中,上样结束后再将芯片浸没在油相(矿物油或PDMS)中,以防止在热循环过程中水分的挥发。
芯片式数字PCR以Life Technologies公司的Quant Studio™ 3D与JN Medsys公司的Clarity系统为代表。
前者需使用特定的PCR扩增仪进行热循环扩增,而后者仅需将芯片浸没于PCR反应管中于普通PCR仪即可进行PCR扩增。但二者荧光信号的读取方式均为荧光成像,有别于微滴式数字PCR的单独检测方式。
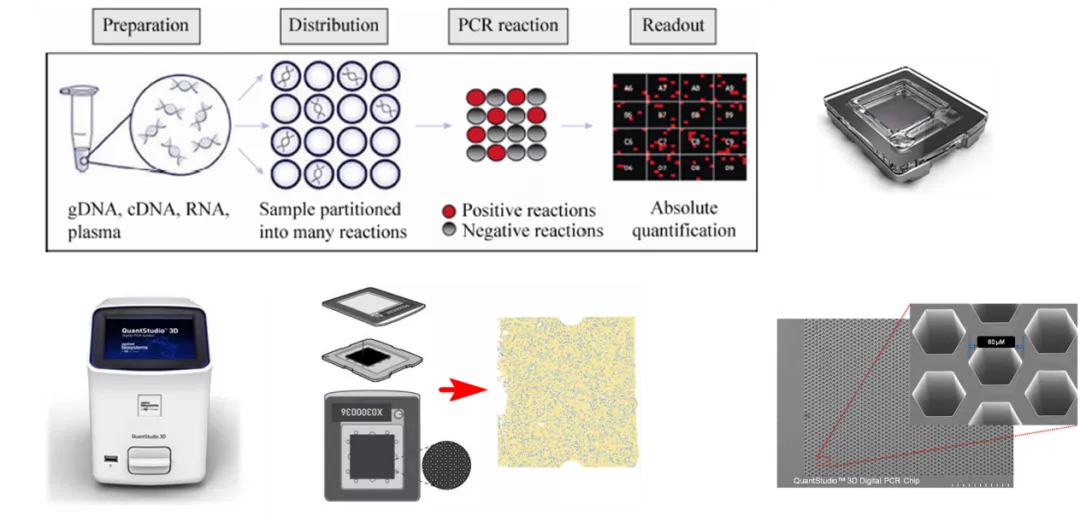 Life Technologies公司的Quant Studio™ 3D系统
Life Technologies公司的Quant Studio™ 3D系统
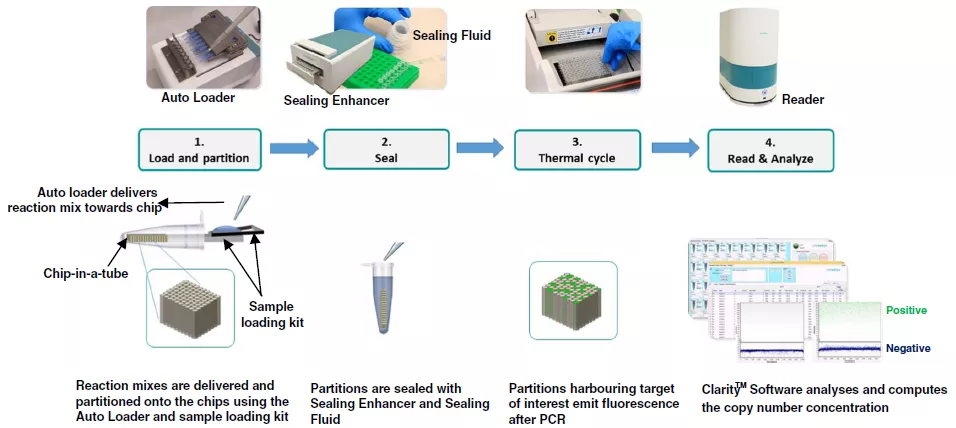 JN Medsys公司的Clarity系统
JN Medsys公司的Clarity系统
叁 除微滴式与芯片式数字PCR外,Stilla公司开发出一种将微滴与微阵列芯片相结合的一种技术,其液滴分隔是采用限制梯度(gradients of confinement)的方式将水相(PCR反应液)分散到装满氟化油的腔式芯片中,液滴的大小主要由芯片腔室入口尺寸及梯度角度控制,腔室内油相厚度仅能容纳一个液滴。该系统工作时自动生成和组装单层平铺的微滴,进行单分子PCR扩增与荧光成像分析。该技术另一个特点在于其油相中加入了一种导电性的表面活性剂用以稳定微滴,避免微滴在热循环中的发生由于电融合(electro-coalescence)或破乳造成的微滴损失,同时无需在水相中加入额外的表面活性剂,保证PCR反应体系的独立性与灵活性。
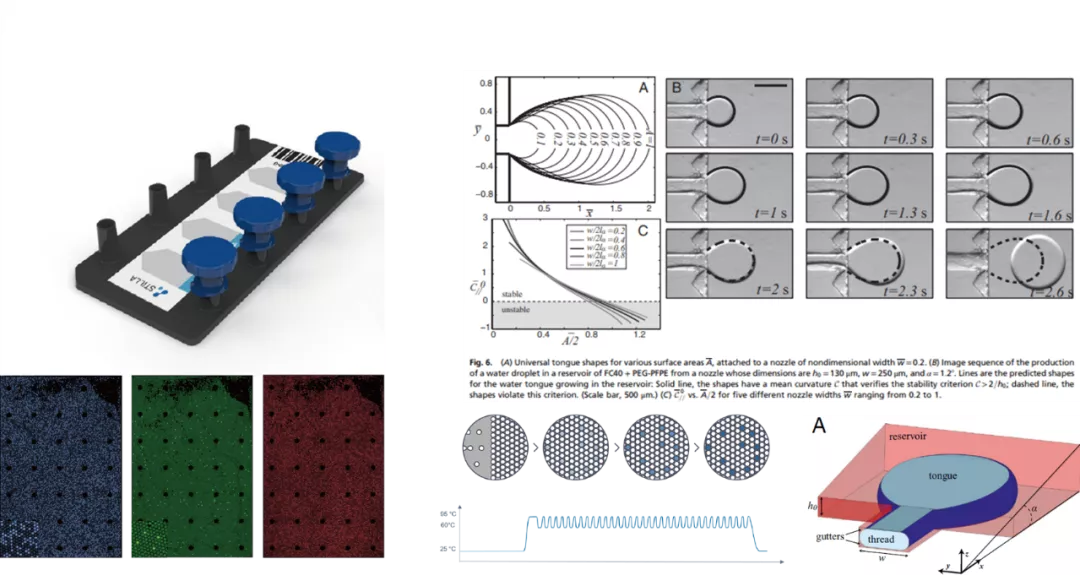 Stilla公司的NaicaTM Crystal系统
Stilla公司的NaicaTM Crystal系统
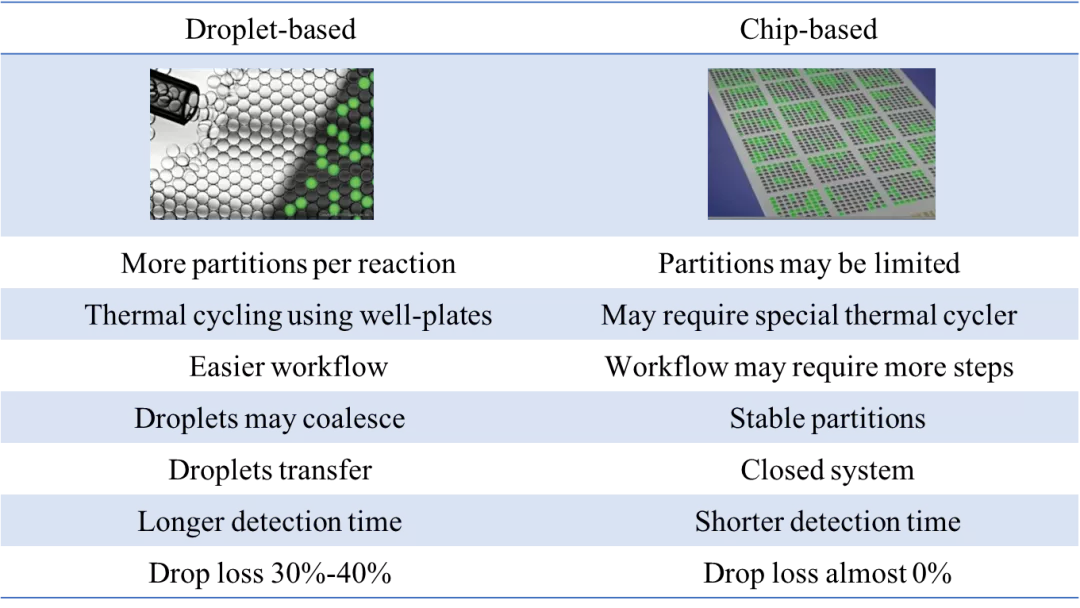
数字PCR分散相分隔策略的不同导致它们各自具备不同的优缺点。对于微滴式数字PCR,优势在于每个反应微滴数可拓展至很高的数量,热循环过程可在PCR管或PCR板上进行,操作更简单;其缺点在于微滴可能发生融合,微滴需转移,检测时间长,操作过程中可能有约30%~40%微滴的损失。对于芯片式数字PCR,芯片的微孔或微管数目是固定的,这就导致其分区数受到限制,扩增时可能需要特殊的热循环设备,操作相对复杂;但其优势也较明显,分区十分稳定,样本在整个检测过程中处于封闭系统,检测时间短,并且几乎没有微滴(分区)损失。
5 数字PCR的应用
数字PCR的应用场景非常广泛,在病原体检测、病毒检测、转基因成分分析、基因表达分析、NGS验证、稀有突变的检测、拷贝数变异检测以及各类临床样本的检测等均有非常大的优势。据Markets and Markets发布的研究报告显示,2019-2024年全球定量PCR和数字PCR市场将以8.8%的年复合增长率增长,从2014年的41.13亿美元增长到2014年的62.7亿美元。其中,定量PCR的年增速为8.37%,从2014年的36.28亿美元,增长到2024年的54.37亿美元;数字PCR的增速更快达11.9%,将从2014年的4.75亿美元,增长到2024年8.34亿美元,而中国为最主要的新兴市场。由于受本次新冠病毒疫情的影响,未来数字PCR的发展将更加迅猛。
 数字PCR目前已经走过了新兴发展阶段,但尚未进入高峰期。该技术在降低成本、操作简便化及设备自动化方面仍然有很大的提升空间。dPCR 与普通PCR、qPCR 相比具有独特的技术优势,实现了单分子绝对定量,使其成为了分子生物学研究中的重要工具,研究者对其应用分析也日益关注。未来如果能有效解决dPCR 耗材成本高、实验通量少、实验操作智能化不足等问题,dPCR将在临床诊断与治疗、微生物检测及食品安全检测等方面拥有更广阔的应用前景,也将成为分子诊断领域又一奔涌的后浪。
数字PCR目前已经走过了新兴发展阶段,但尚未进入高峰期。该技术在降低成本、操作简便化及设备自动化方面仍然有很大的提升空间。dPCR 与普通PCR、qPCR 相比具有独特的技术优势,实现了单分子绝对定量,使其成为了分子生物学研究中的重要工具,研究者对其应用分析也日益关注。未来如果能有效解决dPCR 耗材成本高、实验通量少、实验操作智能化不足等问题,dPCR将在临床诊断与治疗、微生物检测及食品安全检测等方面拥有更广阔的应用前景,也将成为分子诊断领域又一奔涌的后浪。
图文来源:一办综合办公室












