2024上海医疗器械创新展Medtec带您一文了解神经介入导管的设计基础
2024-09-25
引言
想致富就先修路,对于这个观点2024上海医疗器械创新展Medtec相信大家一定不会反驳。不过修路这事说着容易,实际操作过程中材料的选择,宽窄,承重都是我们要考虑进去的因素。同样在神经介入手术中,导管就是我们的路,虽然临床老师对如近端支撑性、远端可通过性和导管内腔尺寸等参数很了解,但是导管工程师又是如何实现这些性能目标的呢?那今天我们就以一篇关于导管的设计和材料介绍的文章为基础,更加深入的来了解一下导管设计和制造的基本概念。
导管是如何制造的?
导管必须足够大,以容纳治疗用的器械和/或造影剂注射,为啥要说和呢?比如使用长鞘配合抽吸导管,如果长鞘和抽吸导管中间间隙不足,就无法通过长鞘进行造影观察远端血管情况;足够小以适应标准动脉鞘管;近端要有足够的硬度以提供支撑;远端则要柔软以便通过弯曲复杂的解剖结构,且必须耐扭曲,内腔需具备润滑性以促进器械的通过,外层也应有良好的润滑性以增强操作灵活性。
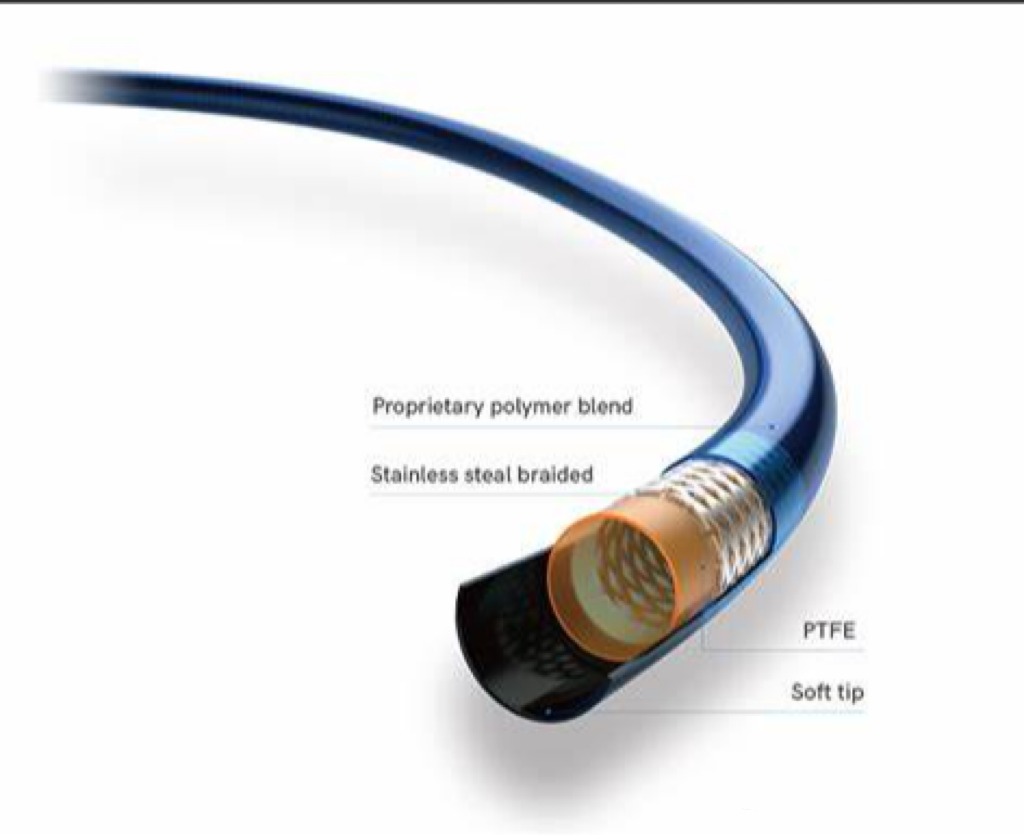
为实现这些特性,导管的基本结构包括四个元素:
一个极薄的润滑里衬(通常为聚四氟乙烯PTFE)、一个支撑骨架(通常由金属材料制成)、一个聚合物外层以及通常限于设备远端的亲水涂层。每个元素的材料选择、厚度、结构模式和使用范围会根据具体的临床需求定制,以实现所需的远端可通过性和器械的通过能力。
制造过程首先将润滑里衬(通常为PTFE)放置在非常硬的芯轴–Mandril(若为金属)或芯体–Core(若为非金属)上。非金属芯体通常用于软性器械的制造,因为需要的是芯体的延展而非简单地从金属芯轴上拉动(可能会损坏器械)。润滑内芯的理想特征包括高润滑性、超薄结构和耐久性,以避免在设备操作过程中受损。因此,PTFE是导管制造中最常用的内衬材料,厚度范围通常为0.0004英寸至0.001英寸,取决于导管的内径。

(裸芯[A]和带有PTFE里衬和编织层的芯[B]示例)
内衬选择相对有限,但支撑骨架的类型、模式、材料和加工方式则有多种选择。金属材料主要包括不锈钢(相对廉价)和镍钛合金(具有形状记忆特性)。无论哪种材料,骨架的制造模式差异很大。一般而言,导丝以线圈或编织形式应用于内衬上,或者两者结合使用。这些导丝可以是圆形或扁平的,通常用于神经血管的导丝直径为0.001英寸到0.004英寸不等。
2024上海医疗器械创新展Medtec同期推出ADTE 高端有源医疗装备技术展汇集国内外高端医疗器械生产厂商,助力中国高端医疗器械国产化。此外,现场还将举办有源医疗设备核心部件与技术论坛,议题涵盖物联大趋势下传感器如何助力前端数据采集、探测器在有源设备中的应用及发展、特殊材料在有源部件上的使用等。现在注册参观即可免费参会>>>

线圈设计因其出色的环形强度而受到青睐,能够避免导管变形或扭结。影响线圈性能的设计因素包括导丝直径和厚度,较大的直径提供更多的硬度和抗扭结性,但会限制远端的柔软性。
在导管的长度上,可以使用不同的线圈类型,因为很容易在设备的某一处终止一种线圈并开始另一种线圈。线圈之间的距离(也称为“螺距”)对硬度、抗扭结性和推送性有显著影响,较宽的螺距可以提供更好的柔软性,但会增加扭结的风险并降低推送性。

编织结构虽然具有较好的硬度,并且与线圈相比具有更强的推送能力,但也可能容易发生扭结。编织设计包含许多特征,例如导丝数量、单股或双股编织、编织图案(上下交错等),以及在同一编织中使用不同的导丝类型。与线圈不同的是,编织结构相对较难在导管制造的中间终止。编织结构性能的主要驱动因素是导丝密度(每英寸导丝数量,即PPI),通常较高的PPI提供更好的抗扭结性和柔软性。然而,PPI的范围非常广,过高的PPI虽然最初能提高柔软性,但在极端情况下反而会变得非常硬。与线圈一样,导丝的直径也是决定硬度的关键因素。编织角度也会影响导管的性能,随着编织角度减小,编织导丝的方向与导管纵轴平行,这显著提高了导管的推送能力。另一方面,较高的编织角度意味着导丝的方向与导管纵轴垂直,编织结构的表现会更接近线圈。

聚合物外层
在增加了支撑结构(无论是线圈、编织结构,还是两者兼有)后,会在导管轴上覆盖一层聚合物外套(导管皮)。这种聚合物材料还包含金属(通常为铋、钨或钡)显影剂,以增加导管的显影性。最常用的聚合物是聚醚嵌段酰胺(PEBA)和尼龙。尼龙因其硬度而受到青睐,而PEBA则较为柔软,并可以通过与尼龙的混合使用来结合聚氨酯的柔韧性和尼龙的强度。制造商可以根据需要调节PEBA混合物中尼龙的比例,从而控制导管的柔韧性和硬度,就比如ACE68抽吸导管有16个节段的设计。因此PEBA在神经血管导管的设计中受到广泛应用。
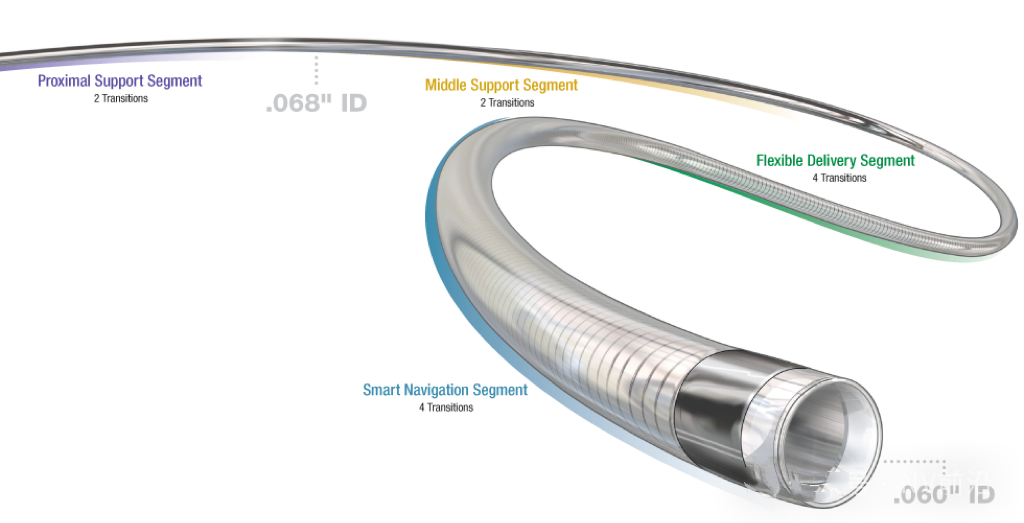
(比如ACE60有12个节段)
亲水涂层
在最后阶段,导管会被浸入聚氨酯基的亲水涂层溶液中,并以一定速度取出。接下来,亲水涂层通过加热或紫外线照射进行固化。可能需要多次浸涂循环以达到所需的涂层厚度。神经血管导管的整体结构总结在下图中。
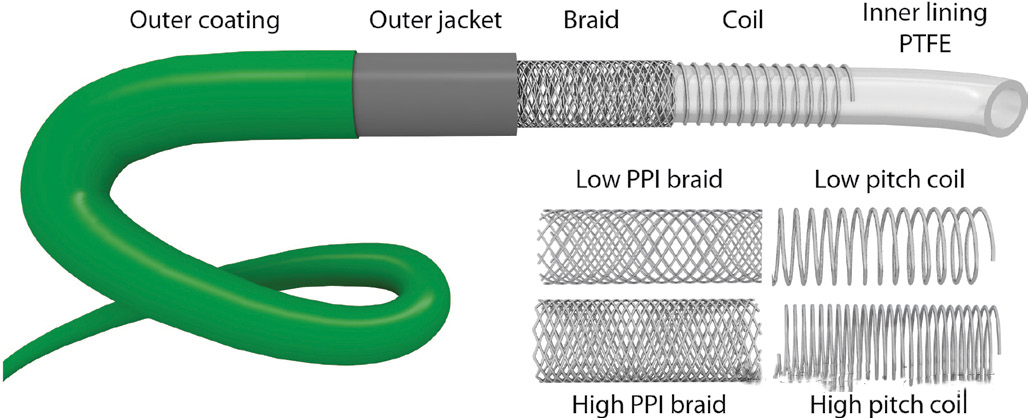
【现代神经血管导管的结构。一般来说,导管的核心和内衬(通常是聚四氟乙烯)上会覆盖有线圈或编织结构,或者两者兼有(混合设计)。线圈和编织设计的特征差异(编织角度、编织密度(pics-per-inch)以及线圈的螺距)可以显著影响神经血管导管的性能特性。尽管该图中未显示,但值得注意的是,同一导管的不同节段(例如近端和远端段之间的编织密度值)中,线圈和编织结构可能会有所不同。外层护套覆盖着线圈和编织线,并通常包含一种显影材料。外层的亲水涂层是导管的最外层,可减少导管在到位过程中产生的摩擦。】
质量控制
导管制造中使用了多种机制来控制其质量。首先是制造流程文件,该文件作为每个产品生产的逐步指南。该文件详细描述了制造步骤,在关键节点进行过程中的检查以筛选出有缺陷的部件,并在最终检查时使用三轴测微计测量关键尺寸,如外径。那些不需要检查的设备特征通过流程验证来统计验证输出结果,以避免检查。一个很好的例子是亲水涂层长度,监管驱动的导管样本会被制造出来,以验证涂层过程是否能产生适当的涂层长度,这个可以通过在完成的导管上涂抹一种紫色染料(甲苯胺蓝)来实现,该染料只会与透明的亲水涂层结合,从而可以测量涂层的长度。
美国食品药品监督管理局(FDA)及其他监管机构要求在过程和成品阶段进行严格的质量控制,每个导管制造商都采用不同的严格质量控制标准,以减少设备在临床环境中的故障。然而,这些质量控制步骤并不能完全避免导管故障和相关的不良事件。例如,目前FDA的制造商和用户设施设备体验(MAUDE)数据库中报告了超过1000例再灌注导管故障,其中约10%的故障与临床不良事件相关。还存在发表的病例研究表明,手术中导管尖端的膨胀和破裂可能导致永久性神经缺损和死亡。因此,上市后的监测也是最重要的质量控制步骤之一。
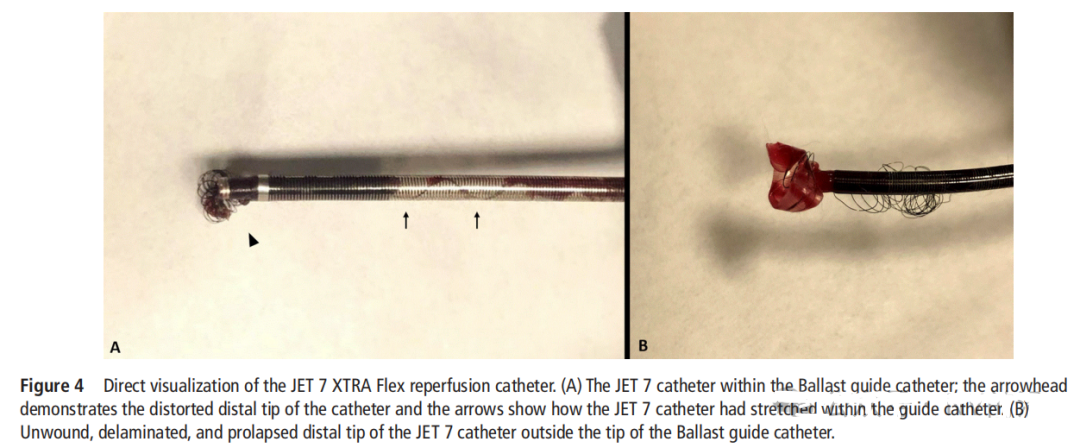
导管的机械性能
硬度计刻度
硬度计刻度(Durometer scale)是衡量弹性体硬度的指标,医疗导管工程师广泛使用它来比较不同聚合物的柔韧性。在此刻度中,较高的数值表示材料更硬,通常柔韧性较差。另一方面,弯曲模量(flexural modulus)是衡量材料弯曲倾向的指标。2024上海医疗器械创新展Medtec发现通常材料的硬度与弯曲模量之间存在一定的相关性。然而硬度计刻度依然只是柔韧性的间接指标,因此,较低的硬度计刻度并不总是意味着更好的柔韧性。此外,硬度计刻度与其他导管性能指标(如抗扭结性、可操作性和推送性)没有很好地相关性。
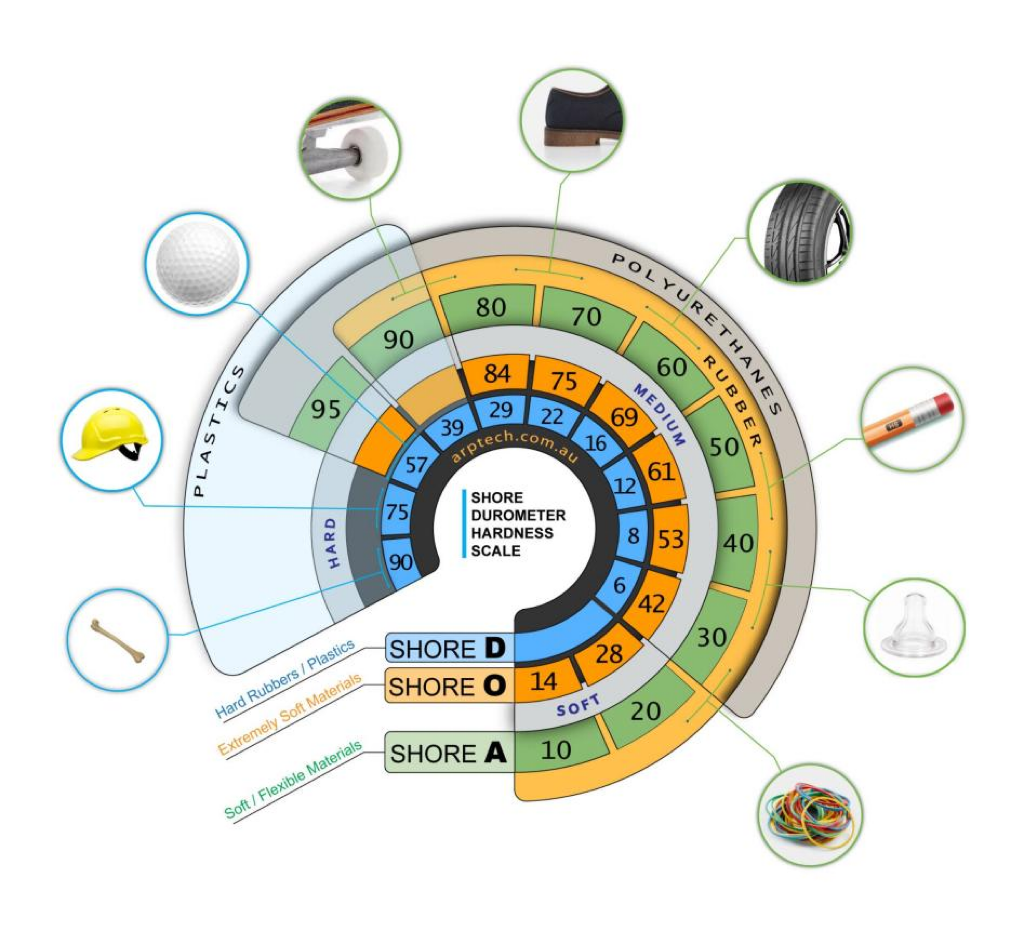
(肖氏硬度计说明)
(弯曲模型)

(右下为欧拉-伯努利)
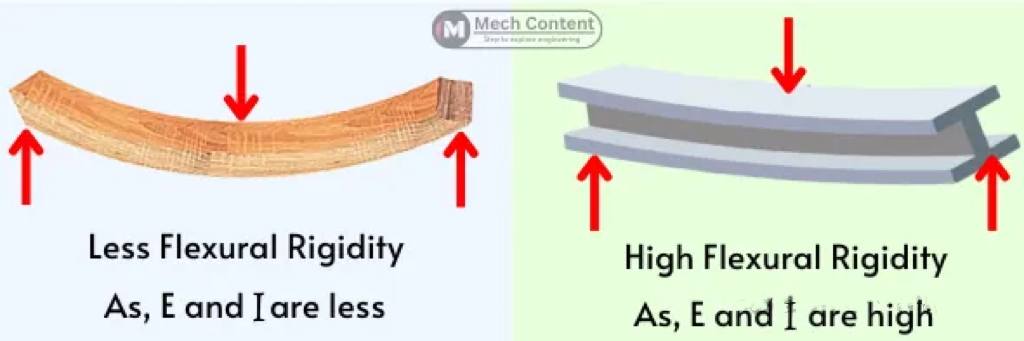
(弯曲刚性高低的对比)
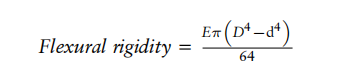
其中:
E = 导管材料的弹性模量;D = 导管的外径;d= 导管的内径
轴向刚性和屈曲力
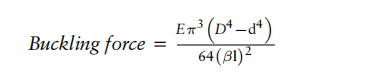
其中:
E = 导管材料的弹性模量;D = 导管的外径;d = 导管的内径;β=夹紧系数;l= 导管长度
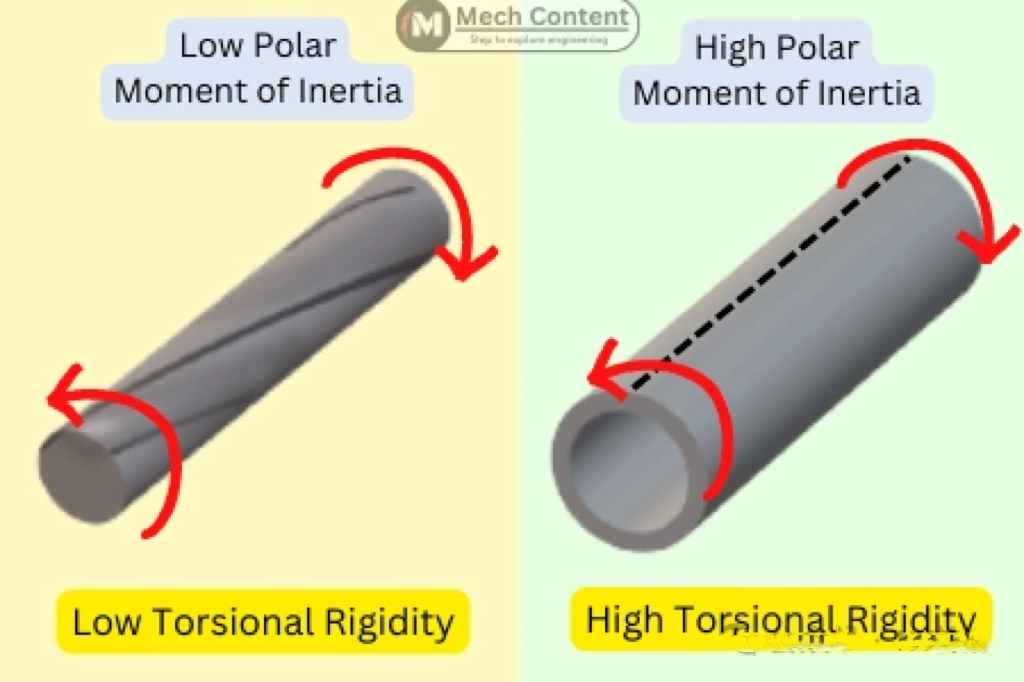
扭转刚性
扭转刚性(Torsional rigidity)是指弹性体对沿其旋转轴进行的角度扭转运动的抗性。导管的可操作性与弹性体的扭转刚性之间存在很强的关系。随着扭转刚性的增加,近端操作更容易传递到远端尖端。此外,随着扭转刚性的增加,施加的力会导致远端尖端的移动更小,从而提供更精确的导管控制。
扭转刚性可通过两种基于远端尖端扭矩或模量与壁厚的公式进行测量:
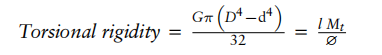
其中:
G = 导管材料的抗剪模量;D = 导管的外径;d = 导管的内径;l
= 导管长度;Mt= 扭转力矩;φ= 扭转角度
扭结
随着弯曲运动的增加,导管的曲率半径会减小。当导管达到临界曲率半径时,导管会发生扭结(Kinking),其内腔被阻塞。
我们可以通过以下公式计算临界曲率半径:
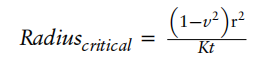
其中:
r = 导管的外半径;t = 壁厚;n = 泊松比(是指材料在单向受拉或受压时,横向正应变与轴向正应变的比值,也叫横向变形系数,它是反映材料横向变形的弹性常数。);K = 材料的扭结常数
设计特征与性能的关系
根据上述公式,在导管构造之前可以得出一些相对简单的物理关系。需要注意的是,像弯曲刚性和屈曲力这样的特性与导管外径的四次方相关,这意味着实现大直径设备的柔软性可能具有挑战性,而实现小直径设备的高硬度同样会很困难。下表总结了设计特征与性能指标之间的关系。
表1比较了导管的不同设计特征与其在操作中的几项关键性能指标之间的关系。这些指标包括:硬度(Stiffer)、抗扭结性(Kink resistance)、可操作性(torquability)和推送性(pushability)。该表展示了如何通过改变导管的某些设计特征,来影响这些关键性能指标。
外层(Outer Jacket)
1. 厚度:增加外层厚度,会提高硬度、抗扭结性、可操作性和推送性。
2. 材料类型:较高的硬度计材料提供更好的硬度和可操作性,而较低的硬度计材料则更有利于抗扭结性。
尺寸(Dimensions)
1. 内腔尺寸(Lumen Size):较大的内腔尺寸增加推送性,但降低抗扭结性。较小的内腔尺寸则有助于提高抗扭结性。
2. 壁厚(Wall Thickness):较厚的导管壁可以提高硬度、抗扭结性、可操作性和推送性。
线圈结构(Coil Construction)
1. 导丝尺寸(Wire Size):较粗的导丝有助于提高硬度、抗扭结性、可操作性和推送性。
2. 导丝材料(Wire Material):不锈钢导丝提供更好的硬度和可操作性,而镍钛合金导丝则具有更好的抗扭结性。
编织结构(Braid Construction)
1. 导丝尺寸(Wire Size):较粗的导丝提高硬度和可操作性。
2. 导丝材料:镍钛合金导丝在抗扭结性方面表现优于不锈钢导丝。
每英寸编织数(PPI)
1. 较高的PPI:最初会增加导管的柔韧性,但如果PPI过高,导管会变得僵硬。
这些特征是通过调整不同的设计参数来优化导管的特定性能。例如,在需要高推送性和硬度的情况下,可以选择更厚的外层和较高的硬度计材料。而在需要更好的抗扭结性时,选择较低硬度计材料和较小的内腔尺寸会更合适。
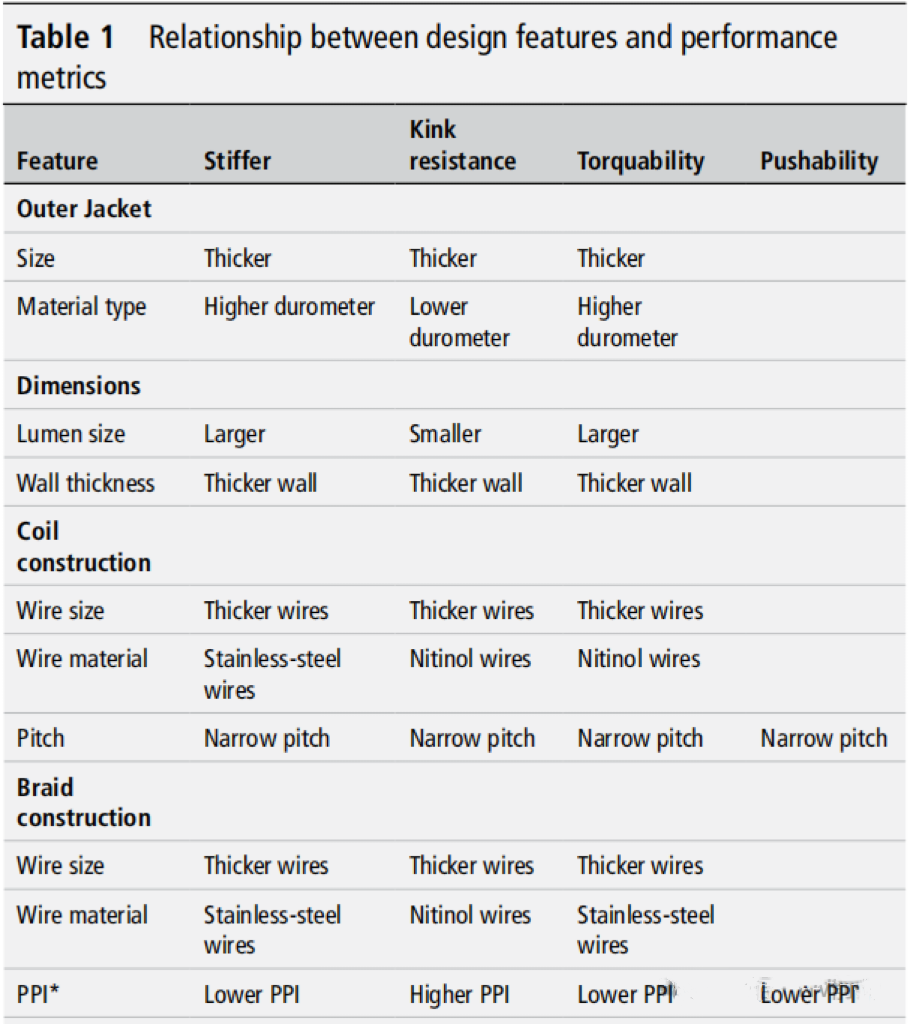
(表1 设计特征与性能指标的关系)
1. 抗扭结性
较低的硬度计刻度和较厚的外层、更小的内径(ID)、更厚的导管壁,以及较厚的线圈或编织线可以提供更好的抗扭结性。此外,镍钛合金丝的抗扭结性优于不锈钢丝。
2. 硬度和可操作性
随着导管壁厚的四次方增加,硬度和可操作性也会增加。此外,较小的内径、较厚且高硬度计刻度的外层都是提高导管硬度和可操作性的特征。线圈和编织设计以及导丝特征也会影响导管的硬度和可操作性。不锈钢导丝比镍钛合金导丝更硬,并提供更好的可操作性。此外,编织设计比线圈提供更好的硬度和扭转控制。
聚合物的硬度与弹性模量之间存在恒定关系(G/E: 0.4-0.5)。因此,使用传统的导管设计策略,很难同时实现低弯曲刚性和高可操作性。正因为如此,我们目前尚无一种能够兼具所有优点的完美导管,导管设计需要根据具体的性能需求进行权衡(这也是为啥我们需要同轴技术)。例如,对于诊断导管来说,高可操作性对于实现血管超选至关重要。然而好的可操作性伴随着高弯曲刚性,这解释了为什么我们可以将8F的抽吸导管推进到大脑中动脉,却无法将4F的诊断导管推进到颅外颈动脉的远端。
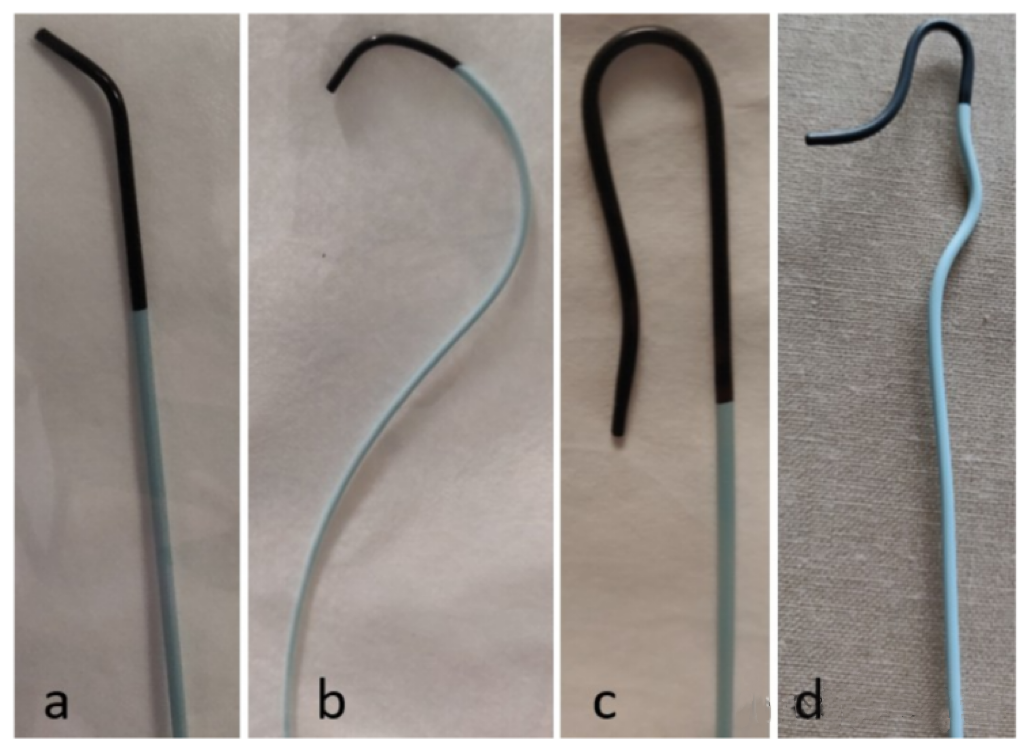
(不同头型的诊断导管,更有利于帮助超选进入目标血管)
不同导管类型的性能需求与设计特征


制造商几乎总是为大口径导管采用混合编织和线圈设计。与微导管设计类似,近端采用编织以获得支撑,而远端则使用线圈以提高导管的可通过性和环形强度(在负压下防止坍塌)。不过与微导管设计不同的是,镍钛合金丝在线圈设计中并不占主导地位。镍钛合金丝提供了更好的形状记忆性和抗扭结性,有助于减少导管回退到主动脉的风险,并在血管弯曲处提供更好的推送性。因此,镍钛合金和不锈钢丝在大口径导管设计中同样受欢迎。此外柔软的外层材料在大口径导管中也很常见,几乎每个制造商都会使用PEBA聚合物,因为它们的柔韧性优异。
未来方向

(Bendit 21微导管)
每一种导管都有其独特的设计,因此具有不同的优点和局限性。通过临床实践来提高对导管性能的了解是最可靠的,但它也存在局限性。市面上有各种各样的导管,想通过临床实践来全面了解所有导管并不容易。但通过导管设计的基本知识可以帮助我们洞悉导管的潜在临床性能特征。关注导管设计的特征,并在临床实践中将导管的临床表现与设计特点相结合,通过这种方式,相信能帮助我们更好地进行器械选择,更有效率的解决临床问题。
参考文献:Catheter design primer for neurointerventionalists
文章来源:NV前沿











