法规政策
-
2020.02.28
上海市药品监督管理局关于发布医疗器械注册人制度试点相关行政许可事项办事指南的通知(2020年2月25日)
为深入推进上海市医疗器械注册人制度试点工作,制定了本市实施医疗器械注册人制定试点期间相关行政许可事项办事指南,现将有关要求通知如下:

阅读更多 -
2020.02.26
最新 ‖ 欧盟GMP附录《无菌药品生产》改名《无菌产品生产》
2月20日,欧盟委员会健康与食品安全局发布了欧盟GMP附录一《无菌产品生产》进一步草案。新修订文件向相关组织和利益相关者征求意见,为期3个月

阅读更多 -
互联网药品与医疗器械经营资质与审批
近年来互联网医药服务逐渐走入人们生活,在互联网增进医疗服务的同时,相应监管也在不断升级。本文整理了互联网药品与医疗器械相关的主要证照,梳理互联网医药、医疗器械服务的资质条件。

阅读更多 -
2020.02.18
1月1日起医疗器械税款有变,涉内窥镜、支架等多类产品
日前,国务院官网转载人民日报消息。内容指出,二〇二〇年一月一日起我国调整部分商品进口关税,涉及大批医疗器械。

阅读更多 -
2020.02.14
AI软件医疗器械研发中的合规要点
采用深度学习算法的计算机软件(“AI软件”)已经在医疗领域投入实用,在疾病的诊断和治疗方面发挥辅助决策作用。美国在2018年即已批准第一个AI诊断决策支持软件,而中国国家药品监督管理局(“药监局”)也于2020年1月开始批准了若干基于深度学习技术的软件医疗器械。由于医疗器械软件的研发不同于普通软件,面临更多的监管,因此AI软件医疗器械的研发过程中有很多特别的合规事项值得注意。

阅读更多 -
2020.02.12
疫苗信息化追溯体系建设常见问题
疫苗信息化追溯体系建设常见问题汇总解答
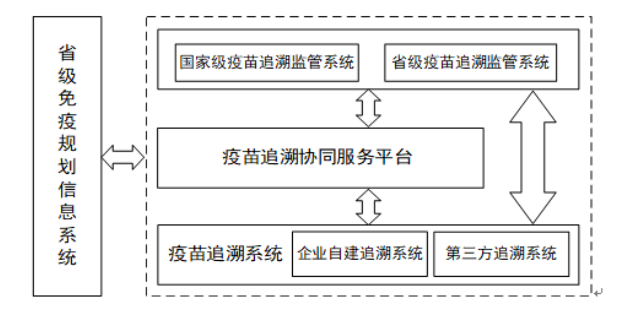
阅读更多 -
2020.02.11
绿色应急通道:紧急进口未在中国注册医疗器械
1月27日,国家药品监督管理局医疗器械监督管理司发布《关于紧急进口未在中国注册医疗器械的意见》,为已经取得美国FDA审批、欧盟医疗器械CE认证和日本医疗器械上市许可,但未完成NMPA进口医疗器械注册的器械,开通绿色应急通道。

阅读更多 -
2020.02.03
新型冠状病毒检测试剂快速申报分析
我国医疗器械审批已全面提速,患者正在越来越及时的用上各种创新医疗器械,相关产业也从高速迈向高质量发展。目前,国家药监局推出了创新、优先和应急等三条快速审批的特殊通道,还实现了电子申报等医疗器械审批整体流程的优化。

阅读更多 -
2020.01.14
医疗器械注册常见问题答疑
医疗器械注册时常遇见疑难问题,本文就最常见的问题进行逐一解答。

阅读更多 -
2020.01.06
重磅通知:中国《定制式医疗器械监督管理规定》2020年1月1日正式施行
3D打印技术在医疗器械领域的应用,正在逐渐显示出强大的个性化定制的能力。但是之前由于没有相关的法律法规,医疗3D打印应用进展缓慢;现在有了规定,终于有规可循有法可依了!

阅读更多












