法规政策
-
2019.12.12
医疗器械唯一标识数据库上线
医疗器械唯一标识数据库是医疗器械唯一标识系统的重要组成部分。按照《医疗器械唯一标识系统规则》的要求和《医疗器械唯一标识系统试点工作方案》的安排,医疗器械唯一标识数据库于2019年12月10日正式上线,面向试点企业开放针对试点品种的唯一标识相关数据申报功能。
阅读更多 -
2019.11.13
用于判定医疗器械与安全性有关特征的问题
条款4.2 中要求制造商判定器械可能影响安全性的特征,考虑这些特征是进行 4.3 中要求的医疗器械危害判定的最根本的一步。
阅读更多 -
2019.11.08
同品种医疗器械临床使用数据评价路径常见问题浅析
通过同品种医疗器械临床使用数据进行分析评价是《医疗器械临床评价技术指导原则》中的三种临床评价路径之一,该评价路径要求繁琐内容较多,很多申请人在采用此评价路径时出现不少问题,文章对这些常见问题进行浅要分析。
阅读更多 -
体外诊断仪器重点技术问题解析
随着体外诊断行业的迅速发展,体外诊断仪器的注册申报量也越来越大。文章根据该类产品的特点,参考国内外相关法规和技术文件,对该类产品注册申报中的重点技术问题进行解析,旨在为该类产品的设计开发和注册申报工作提供一些指导性建议。
阅读更多 -
2019.11.07
如何推动创新医疗器械产业发展,官方答复了
近日,国家药监局会同国家医保局就有代表提出的关于如何推动医疗器械产业创新机制试点的建议进行了答复。

阅读更多 -
药械组合产品申报常见问题的思考
药械组合产品以安全有效为上市的首要原则,这就需要从不同角度全面思考评价方法,以保证组合产品整体安全有效。本文从技术评价角度,结合近年来药械组合产品的审评情况,详解现阶段药械组合产品技术审评的思路,为该类产品的申报注册提供参考借鉴。
阅读更多 -
2019.11.05
全国首个跨省医疗器械注册人制度来了
今日(10月29日),上海市、江苏省、浙江省、安徽省四地药品监督管理局联合发布《长三角医疗器械注册人制度试点工作实施方案》(以下简称方案),这也是全国首个跨省医疗器械注册人制度的落地

阅读更多 -
2019.09.18
UDI 来袭!10月1日全国医疗器械统一编码
10月1日起,全国医疗器械统一编码正式实施!每个医疗器械产品真正有了唯一一张“身份证”,并且从生产、加工到流通、配送、使用全流程可溯源、全过程监管!
阅读更多 -
2019.09.04
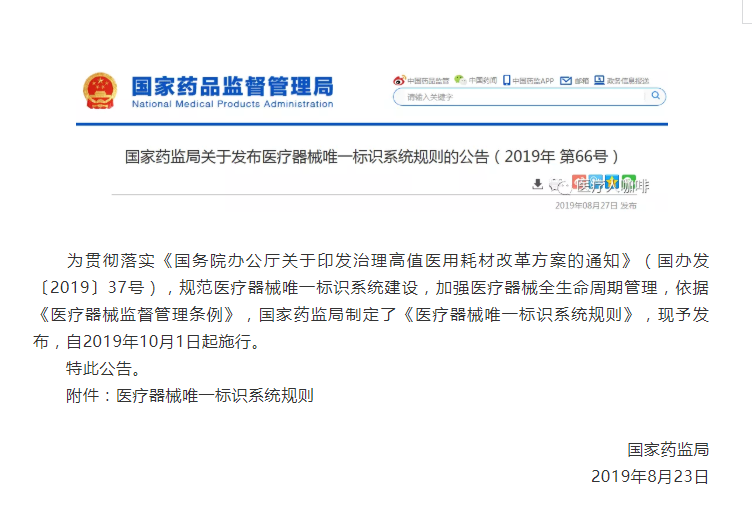
【NMPA】《医疗器械唯一标识系统规则》正式发布(附全文及解读)
为贯彻落实《国务院办公厅关于印发治理高值医用耗材改革方案的通知》(国办发〔2019〕37号),规范医疗器械唯一标识系统建设,加强医疗器械全生命周期管理,依据《医疗器械监督管理条例》,国家药监局制定了《医疗器械唯一标识系统规则》,现予发布,自2019年10月1日起施行。
阅读更多 -
2019.09.02
中国医疗器械 UDI 规则正式发布
医疗器械实施唯一标识/UDI监管制度,经过长时间的公开讨论和征求意见,在8月27日国家药监局组织的专题会议上正式对外公布。UDI规则自2019年10月1日起施行
阅读更多












