2024医疗器械展会Medtec无源医疗器械安全性评价第二部分:货架有效期
2024-08-20
医疗器械注册阶段,货架有效期部分研究至关重要,货架有效期研究是确保产品在规定期限内能够正常发挥预期功能的重要证据。当医疗器械超过货架有效期研究规定的最大期限,器械的性能可能无法得到保证,在使用时则存在潜在风险。
因此,基于风险原则考量,注册申报阶段注册申请人需要对医疗器械的货架有效期进行研究,此研究也是产品设计开发过程中的关键动作。
考虑到医疗器械种类繁多,不同的产品开展研究遵循的法规、标准各有不同,2024医疗器械展会Medtec转载本篇仅聊聊无源器械的货架有效期验证方面的问题,有源器械不在讨论范围内。
一、医疗器械货架有效期研究需要考虑内外部环境因素,是因为这些因素会对医疗器械的稳定性和性能产生影响。外部因素包括储存条件(温度、湿度、光照等)、运输条件(如震动、冲撞等),以及生产环境等,而内部因素则涉及医疗器械原材料或组件自身的性能退化、组件间的相互作用、以及与包装材料的相互作用等。
二、医疗器械货架有效期研究通常分为加速稳定性试验和实时稳定性试验两种类型。加速稳定性试验是指通过在较高温度等外部应力条件下存放产品,来预测在正常储存条件下的材料退化情况,申请人可以根据阿列纽斯反应速率函数建立加速老化简化公式:
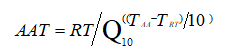
AAT:加速老化时间(申请人自行确认);
RT:实时老化时间;
Q10:温度升高或降低10℃的老化系数(Q10=2);
TAA:加速老化温度(不超过60℃);
TRT:预设的实际储存温度环境温度(25℃)。
2024医疗器械展会Medtec展前会分论坛将隆重举办分论坛2:质量提升与体系、标准建设,本次会议将邀请行业大咖一起对行业内备受关注的质量热点内容进行解析和讨论,致力于为医疗器械法规和质量人员提供最新的标准资讯,并且制定有效的实施策略。最大限度的为从业者答疑解惑。报名参观>>>
实时稳定性试验则是在实际储存条件下进行,直至产品性能不符合规定要求为止。当这加速老化和实时老化试验结果不一致时,需要以实时稳定性试验结果为准。
前期注册的时候,申请人可以先提交加速老化结果以及实时老化进度,待后面实时老化结束后再补充提交实时老化结果。
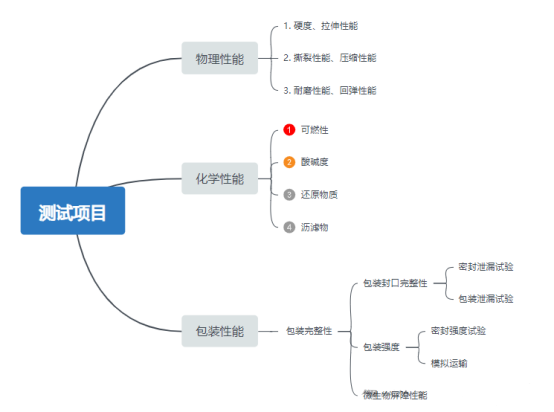
三、加速老化/实时老化测试项目:
四、试验观察时间点
在加速老化和实时老化试验中,申请人应根据产品特性和预期贮存条件进行评估,设定合适的观察时间点。例如,在加速老化试验中,可以根据设定的加速老化时间(AAT)和实际老化时间(RT)的关系,以及加速老化因子(AAF)来确定时间点。在实时老化试验中,可以根据产品预期的货架寿命和实际使用条件来设定观察时间点。
五、举例:生物敷料的加速老化和实时老化试验方案
1.确定试验条件
加速老化温度(TAA):设定为55℃。
实际储存温度(TRT):设定为25℃。
老化系数(Q10):设定为2。
2.计算老化时间
利用Q10公式计算加速老化时间与实际老化时间的关系:
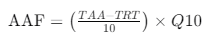
2024医疗器械展会Medtec提醒其中,AAF为加速老化因子。
假设预期的实时老化时间(RT)为2年(24个月),则加速老化时间(AAT)为:
![]()
3.设定观察时间点
加速老化试验:设定在加速老化过程的0个月(零时刻)、3个月、6个月、12个月进行观察。
实时老化试验:设定在0个月、6个月、12个月、18个月、24个月进行观察。
4.样品准备
准备足够数量的生物敷料样品,用于加速老化和实时老化试验。
5.老化试验
将生物敷料样品分为两组,一组置于55℃的加速老化环境,另一组置于25℃的实际储存环境。
6.性能测试
在每个观察时间点,取出样品进行以下性能测试:
微生物屏障性能测试(例如:YY/T0681.10标准下的微生物屏障试验)。
物理性能测试(如抗张强度、断裂伸长率等)。
密封完整性测试(如目力检测、染色渗透试验等)。
7.数据记录
记录每个时间点的测试结果。
8.确定货架有效期
根据加速老化和实时老化试验结果,结合产品性能标准,确定生物敷料的货架有效期。
9.报告撰写
撰写研究试验报告,明确货架有效期的建议。
文章来源:医械注册笔记











