2025上海高端医疗设备展指出,欧盟与美国的区别欧盟与美国的医疗器械的分类有很大的不同。美国的FDA将医疗器械根据其通用的特点事先已经分类并建立了一个公开的数据库可查询;欧盟则是建立了一套分类规则,让制造商根据产品的预期使用目的(Intended Purpose)按照分类规则自己进行分类。
在美国,同一个产品,既可以是医疗器械,也可以不是医疗器械,一个产品是否为医疗器械 完全由FDA决定;
在欧盟,一个产品是否为医疗器械 由制造商(申明的产品预期使用目的)决定, 比如:电热褥既可以是医疗器械,也可以不是医疗器械。同一个产品,可以是不同类别的医疗器械比如:制造商申明的预期使用目的不同,电热褥既可以是I类医疗器械,也可以是II a或II b类医疗器械。同一个产品,作为系统的一部分时与作为配件时属于不同的类别比如:手术过程中用非主动式抽取腹水装置的留在体外的盛腹水的容器,作为系统的一部分时可属于II a类,但是作为配件时则可属于I类。
1:装置包含一种完整的药用物质,并且具有辅助于该装置的作用。Class III, Rule 14
(1)该设备专门用于消毒、清洁、冲洗或隐形眼镜补水 Class IIb, Rule 16
(2)该设备是一种消毒溶液或清洗液,专门用于对侵入性设备进行终端消毒。Class IIb, Rule 16
(3)以上均不适用(Class IIa, Rule 16)
提示:下面选项中“用于记录 X 射线诊断图像的设备是指用于记录图像的 X 射线胶片或数字X 射线探测器,而不是 X 射线机本身。
A:该设备用于记录 X 射线诊断图像 Class IIa, Rule 17
B:该设备含有非活体人类或动物组织、细胞或其衍生物
提示:纳米材料我们主要去考虑内部暴露的高、中、低,例如医疗器械的应用部位、接触类型(例如组织、细胞或体液)、接触时间和纳米材料的掺入类型(游离、固定、嵌入)。当纳米材料作为涂层涂在器件表面时,重要的是要考虑与材料的相互作用类型(化学吸附与物理吸附)。当纳米材料嵌入基质中时,重要的是要考虑材料的可降解性。
例如:以下是一些属于所述每个风险级别的设备示例 – 配方中含有纳米材料的骨填充剂具有高或中等的内部暴露潜力;具有强结合纳米涂层的骨固定螺钉/板内部暴露的可能性很低;而且,牙科填充剂的内部暴露可能性可以忽略不计。
内部暴露的可能性可以忽略不计 Class IIa, Rule 19
内部暴露的可能性低 Class IIb, Rule 19
内部暴露的可能性高或中等 Class III, Rule 19
提示1:吸入药品是指将药物吸入呼吸系统。例如,雾化吸入器和带鼻插管的氧气输送系统的垫片。
提示2:体孔是口、耳、鼻、肛门、尿道、阴道等体内的自然开口,以及眼球的外表面,或任何永久性的人工开口,如造瘘。
您的设备的作用方式是否对所给药药品的功效和安全性有重要影响和/或设备是否旨在治疗危及生命的疾病?
B:它由通过体孔引入体内或涂抹在皮肤上并被皮肤吸收或局部分散在体内的物质组成。
1这些物质被施加到皮肤、鼻腔或口腔,直到咽部,并在这些腔内达到其预期医疗目的 Class IIa, Rule 21
2:物质被人体系统地吸收以达到预期目的 Class III, Rule 21
3:物质在胃或下消化道中达到其预期目的并被人体系统地吸收 Class III, Rule 21
4:以上皆非 Class IIb, Rule 21
6.您的设备是否是兼具诊断功能,并且该诊断功能对病人的病情监控非常重要的有源治疗设备?
提示:其他类型的有源设备(即 MDR 中的规则 9 至 13)相关的其他问题将在小程序的后面部分出现。
提示:侵入性是指任何全部或部分通过体孔或体表穿透体内的装置,如果是能量通过而不是器械本身通过则不能算侵入式。
提示1:手术侵入性:一种侵入性装置,通过身体表面穿透身体,包括借助或在外科手术中通过身体孔口的粘膜;以及通过身体孔口以外的其他方式产生穿透力的装置。外科手术一词包括所有临床介入手术,其中将设备通过身体表面放入体内。手术侵入性装置总是意味着它通过人工创造的开口进入。
提示2:用于尿路造口术、结肠造口术和回肠造口术或永久性气管切开术的手术造口被认为是体孔;因此,引入这种造口的装置不是手术侵入性的。相反,通过手术创建的允许进入循环系统的开口不应被视为体孔。引入这种开口的装置是手术侵入性的。
提示3:植入式设备中的“吸收”是指体内材料的降解以及由此产生的降解产物通过体内代谢消除。它不适用于未经体外修饰而排出的物质,例如用于腹腔或腹腔镜和内窥镜手术的吹气气体。
您的设备是否仅用于口腔、耳道或鼻腔,不易被粘膜吸收?
1: 可重复使用的手术器械:用于切割、钻孔、锯切、刮擦、刮擦、夹紧、缩回、夹紧或类似程序的手术器械,无需与有源设备连接,制造商打算在执行适当的程序(如清洁、消毒和灭菌)后重复使用。Class I, Rule 6
2:它是一种可重复使用的手术器械:旨在以潜在危险的方式给药 (例如带弹簧击发装置的胰岛素注册器) Class IIb, Rule 6
3:它旨在提供能量/电离辐射 Class IIb, Rule 6
4:它具有主要或全部吸收的生物效应。Class IIb, Rule 6
5:它专门用于与心脏、中枢循环系统或中枢神经系统的直接接触 Class III, Rule 6
6:它通过直接接触心脏或中央循环系统用于控制、诊断、监测和/或纠正缺陷。 Class III, Rule 6
1:它旨在在体内发生化学变化(而不是在牙齿中) Class IIb, Rule 7
2:它旨在施加药物(不在牙齿中)Class IIb, Rule 7
3:它旨在提供能量/电离辐射Class IIb, Rule 7
4:它具有主要或全部吸收的生物效应。 Class III, Rule 7
5:它专门用于与心脏、中枢循环系统或中枢神经系统的直接接触 Class III, Rule 7
6:它通过直接接触心脏或中央循环系统用于控制、诊断、监测和/或纠正缺陷。 Class III, Rule 7
1:它旨在放置在牙齿中 Class IIa, Rule 8
2:它旨在用于与心脏或中枢循环/神经系统直接接触 Class III, Rule 8
3:它具有主要或全部吸收的生物效应 Class III, Rule 8
4:它旨在在体内(而不是在牙齿中)发生化学变化 Class III, Rule 8
5:它旨在管理医品 Class III, Rule 8
6:是一种有源植入式装置或有源植入式装置的附件 Class III, Rule 8
7:它是乳房植入物或手术网片 Class III, Rule 8
8:它是一种全部或部分关节置换术、椎间盘置换术或与脊柱接触的植入物
提示:有源医疗设备:任何设备,其操作依赖于人力或重力以外的能量来源,并且通过改变该能量的密度或转换该能量来起作用。用于在有源设备和患者之间传输能量、物质或其他元素的设备,没有任何重大变化,不被视为有源设备。
提示:软件被视为有源设备。使用压缩空气体和/或真空作为动力源的医疗设备也被视为有源设备。通过过滤和离心达到其目的的设备(例如,血液透析器)不被视为有源设备,因为它们仅通过机械方法工作。
如果您的设备用于引导或储存血液、体液、细胞或组织、液体或气体,以便最终输注、给药或引入体内,请在此问题中选择“否”,因为这些设备将在小程序后面讨论。此类设备的一个例子是用于储存血液和组织的冰箱/冰柜。
提示:在选择下列选项前,请确认规则 22 不适用于您的设备。如果此规则适用,请重新返回核对您对问题4的回答。规则 22:具有集成或合并诊断功能的有源治疗设备,可显着决定设备对患者的管理,例如自动心脏起搏器或自动体外除颤器。
提示:如果产品是医疗器械软件 (MDSW),这并不意味着软件规则11自动适用。规则 9-13、15 和 22 其实也都适用于软件设备。因此如果您有软件设备,您需要查看医疗器械软件分类指南 (MDCG 2019-11)。
提示:根据 MDCG 2021-24,确定设备是否以潜在危险的方式管理或交换能量取决于所涉及的技术类型以及设备对患者的预期应用。例如,所有旨在发射电离辐射的设备和所有肺呼吸机都被认为以潜在危险的方式管理能量。
a:它旨在直接控制、监测或影响 IIb 类有源治疗设备的性能 Class IIb, Rule 9
b:它以潜在危险的方式管理或交换能量 Class IIb, Rule 9
c:它旨在为治疗目的发射电离辐射,或控制、监测或直接影响为治疗目的发射电离辐射的设备的性能 Class IIb, Rule 9
d:它旨在控制, 监控或直接影响有源植入式设备的性能 Class III, Rule 9
(2:)它旨在诊断和监测或提供身体吸收的能量,或允许直接诊断或监测重要的生理过程
a:它旨在可见光谱中照亮患者的身体 Class I, Rule 10
b: 它发射电离辐射用于诊断或治疗放射学,包括介入放射学设备和控制或监测此类设备的设备 Class IIb, Rule 10
c: 它专门用于监测重要的生理参数,其中的变化可能导致对患者造成直接危险 Class IIb, Rule 10
d: 它用于在患者处于直接危险的临床情况下进行诊断 Class IIb, Rule 10
e: 以上皆非 Class IIa, Rule 10
a:它旨在可见光谱中照亮患者的身体 Class I, Rule 10
b: 它发射电离辐射用于诊断或治疗放射学,包括介入放射学设备和控制或监测此类设备的设备 Class IIb, Rule 10
c: 它专门用于监测重要的生理参数,其中的变化可能导致对患者造成直接危险 Class IIb, Rule 10
d: 它用于在患者处于直接危险的临床情况下进行诊断 Class IIb, Rule 10
e: 以上皆非 Class IIa, Rule 10
a:该决定的影响可能导致“死亡或不可逆转的健康状况恶化” Class III, Rule 11
b: 该决定的影响可能导致患者健康状况变化或必要的手术干预 Class IIb, Rule 11
c: 以上皆非 Class IIa, Rule 11
B:它专门用于监测重要的生理参数,其中的变化可能导致对患者造成直接危险
它是否旨在监测重要的生理参数,其中参数变化的性质可能对患者造成直接危险?
C:以上皆非 Result: Class I, Rule 11
(5:)它旨在管理和/或从体内加入或去除药物、体液或其他物质
备注:从体内服用或去除药物、体液或其他物质是否具有潜在危险?是否以具有潜在危险的方式执行,应考虑到所涉物质的性质、有关身体部位和使用方式
体内加入或去除药物、体液或其他物质是否具有潜在危险?
(6:)以上皆非 Class I, Rule 13
在继续本组问题之前,请确认规则 14 和规则 22 均不适用于您的设备。如果这些规则之一适用,请再次检查您对问题 1 和 4 的回答。规则14:包含整体药物物质的器械,并且具有与器械的作用相辅相成的器械。规则 22:具有集成或合并诊断功能的有源治疗设备,可显著决定设备对患者的管理,例如闭环系统或自动体外除颤器。
(1:)该设备不接触患者或仅与完整的皮肤接触 Class I, Rule 1
(2:)它用于引导或储存血液、体液、细胞或组织、液体或气体,以便最终输注、给药或引入体内
a:该设备用于接触血液、其他体液、器官、组织、细胞 Class IIa, Rule 2。
b:该设备连接到 IIa 类或更高级别的有源设备设备 Class IIa, Rule 2
c: 该装置是血袋 Class IIb, Rule 2
(3:) 它旨在改变人体组织或细胞的生物或化学组成,以便植入或给药到体内
a: 使用该装置的治疗包括过滤、离心或气体或热的交换 Class IIa, Rule 3
b: 它由在体外与取之于人体的细胞、组织或器官直接接触的物质组成 Class III, Rule 3
c: 它由在植入或给药到体内之前与人类胚胎一起体外使用的物质组成 Class III, Rule 3
(4:)它旨在改变血液或其他体液、液体的生物或化学组成以便植入或给药到体内
a: 使用该装置的治疗包括过滤、离心或气体或热的交换 Class IIa, Rule 3
b: 它由在体外与取之于人体的细胞、组织或器官直接接触的物质组成 Class III, Rule 3
c: 它由在植入或给药到体内之前与人类胚胎一起体外使用的物质组成 Class III, Rule 3
a:该装置用作压缩或吸收渗出物的机械屏障 Class I, Rule 4
b:该装置旨在管理受伤皮肤或粘膜的微环境 Class IIa, Rule 4
c:该装置用于破坏真皮或粘膜的伤口,以便伤口在上述第二条状态下愈合。Class IIb, Rule 4
2025上海高端医疗设备展了解到,美国FDA医疗器械产品目录中共有1700多种。根据风险等级的不同,FDA将医疗器械分为三类(Ⅰ,Ⅱ,Ⅲ)。风险等级逐级升高,Ⅲ类风险等级最高。FDA对每一种医疗器械都明确规定了其产品分类和管理要求。首先,对于任何产品,企业都需进行企业注册与产品列名(Enterprise Registration and Product Listing)。
I 类器械 一般控制(General Control) 绝大部分产品只需进行注册、列名和实施GMP规范,产品即可进入美国市场(其中极少数产品连GMP也豁免,极少数保留产品则需向FDA递交510(K)申请即PMN(Premarket Notification))这些器材只要经过一般控制就可以确保其功效与安全性,如拐杖、眼镜片、胶布等,约占全部医疗器材的27%。这些控制包括:禁止粗制滥造及不当标示的产品销售;FDA禁止不合格产品销售;必须报告FDA有关危害性、修理、置换等事项;限制某些器材的贩卖、销售、及使用;实施GMP(Good Manufacturing Practice)。
Ⅱ类产品(占46%左右) 一般控制 + 特殊控制(Special Control) 企业在进行注册和列名后,这些产品除了上述一般控制之外,其余大多数产品均要求进行上市前通告(PMN:Premarket Notification)(即510K)。少量的II类产品可以豁免上市前通告程序。生产企业须在产品上市前90天向FDA提出申请,通过510K审查后,产品才能够上市销售。 Ⅲ类产品(占7%左右) 一般控制 + 上市前许可(Premarket Approval) 企业在进行注册和列名后,须实施GMP并向FDA递交PMA申请(部分Ⅲ类产品还是PMN)。一般来说,
III类产品多为维持、支持生命或植入体内的器材,对病患具有潜在危险,可能引起伤害或疾病者,如心律调节器、子宫内器材及婴儿保温箱等,约占所有器材的8%。这些器材必须取得FDA的PMA之后方能销售。
对Ⅰ类产品,企业向FDA递交相关资料后,FDA只进行公告,并无相关证件发给企业,很多中介给客户的所谓证书其实都是美代出具的没有法律意义的文件;
对Ⅱ、Ⅲ类器械,企业须递交PMN或PMA,FDA在公告的同时,会给企业以正式的市场准入批准函件(Clearance),即允许企业以自己的名义在美国医疗器械市场上直接销售其产品。
至于申请过程中是否到企业进行现场GMP考核,则由FDA根据产品风险等级、管理要求和市场反馈等综合因素决定。
综合以上内容可知,绝大部分产品在进行企业注册、产品列名和实施GMP,或再递交510(K)申请后,即可获得FDA批准上市。 除了依据器材的风险来分级之外,依照器材的用途,FDA把现有医疗器材产品总共被分成16类(medical specialty “panels”)。
Medical Specialty Regulation Citation (21CFR)
73 Anesthesiology Part 868
74 Cardiovascular Part 870
77 Ear, Nose, and Throat Part 874
78 Gastroenterology and Urology Part 876
79 General and Plastic Surgery Part 878
80 General Hospital Part 880
85 Obstetrical and Gynecological Part 884
89 Physical Medicine Part 890
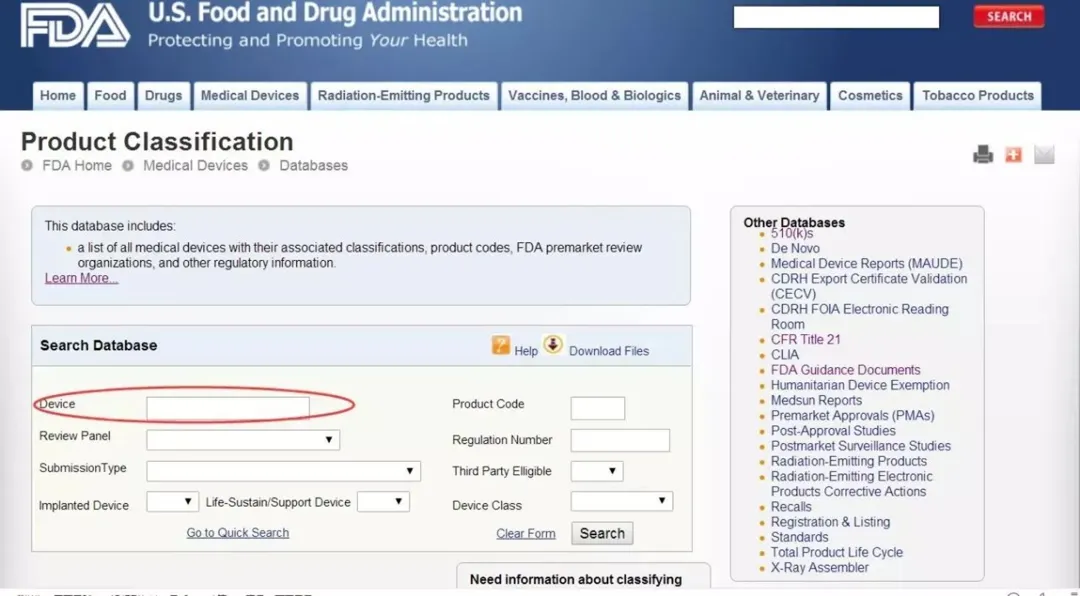
当然,这只是一个大致的分类。具体到某一个器械,属于哪一类,以及是否得到豁免,均需通过查找其相对应的法规编号。1700类产品,每一类产品都有一个法规编号与之对应。那么,如何查找法规编号?方法一:进入FDA官网中的classification database页面(http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpcd/classification.cfm)。您就会看到下方的页面:有两种方法。
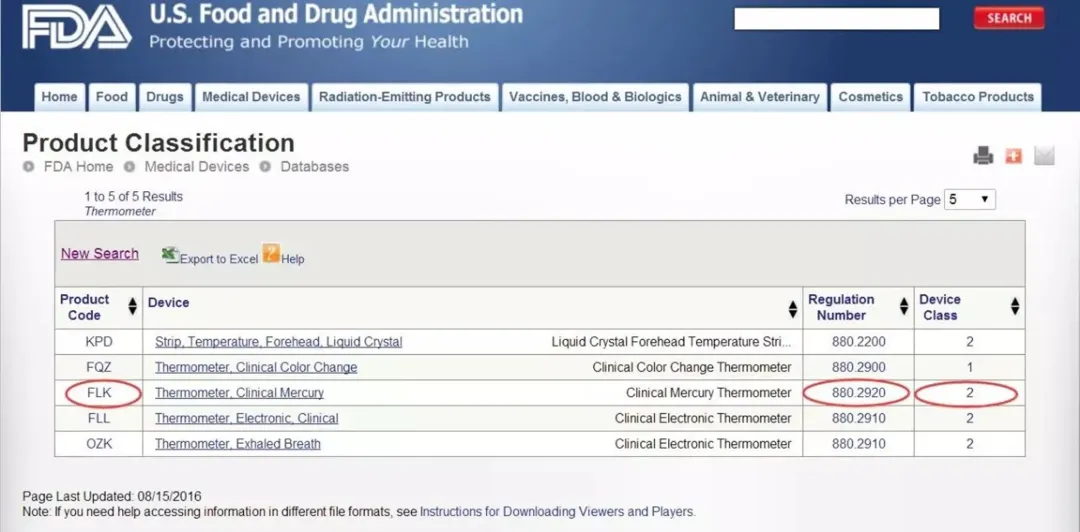
如果您知道器械的部分名称,您就可以找到相对应的法规编号。比如:要找 Clinical Mercury Thermometer这个产品的法规编号,就把Thermometer输进红框中,接着就可以看到下面这个页面。在这里,不仅能够看到法规编号,还可以看到产品代码和器械分类级别。
方法二:如果知晓该器械属于之前所提及的16类中的某一类,就可以进入FDA官网的Device Classification Panels(http://www.fda.gov/MedicalDevices/DeviceRegulationandGuidance/Overview/ClassifyYourDevice/ucm051530.htm)页面搜索。