2025上海医疗设备展Medtec了解医疗器械工艺用水3Q4验证规范与实践
2024-12-05

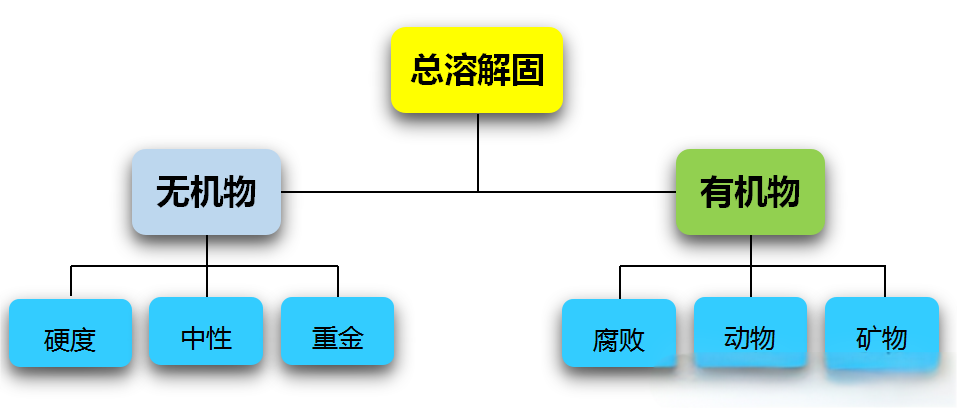
2025上海医疗设备展Medtec指出,水质污染的核心因素:季节变化(温度、微生物) 农业污染(农药、化肥、无机物) 工业污染(有机物) 生活污染(排泄物、微生物) 市政水消毒(氨与氯的化合物) 用户总进水(施工带来的污染)
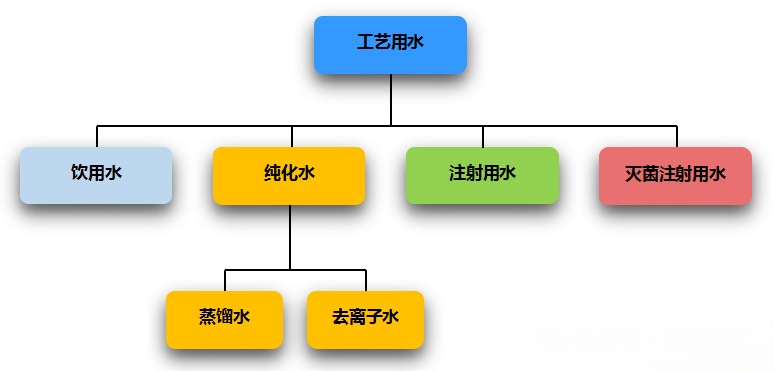
饮用水:为天然水经一定的经处理而得,过滤吸附法、离子交换法 纯化水:蒸馏法、离子交换法、电渗析法、反渗透法,原水为饮用水 注射用水:蒸馏法、超滤法,原水为纯化水 灭菌注射用水:为注射用水灭菌而得
IQ的内容
–系统文件的检查 –系统&ID图纸的检查 –设备清单的检查 –仪器仪表的检查(仅仅检查仪器仪表是否得到校验,不涉及具体的实施校准工作) –使用材料的检查 –焊接质量的检查 –设备排水能力的检查 –公用系统的检查 –酸洗和钝化的检查
OQ的内容
–验证仪器的确认 –系统生产能力的确认(最高生产能力) –系统生参数的确认 –水系统水质确认(由企业自己安排进行水质测试) –系统消毒/灭菌的确认 –系统报警和连锁的确认 –系统操作界面的确认
注射用水-PQ
第1阶段:2-4周 –每个制水工序点和使用点每天取样,连续进行2-4周;
–对于注射水机的使用点(原水),每周测试一次(纯化水检验标准);
–运行参数的确认;–报警限度和行动限度的确认;
–系统清洁和消毒程序和周期的确认;
–确定SOP;
–检验所有规定的项目;第一阶段所有测试完成且合格后,才能使用。
注射用水-PQ
第2阶段:2-4周 –目的:确认水系统能持续生产出合格的水;
–注射水机出水口每天取样,检测所有规定的项目,连续进行2-4周;
–各使用点,每周取样1次,检测所有规定的项目;
–每天除取样计划上进行全检的使用点,其余点需要检验微生物限度和细菌内毒素;
第3 阶段:1年 –目的:确认季节变化对水质的影响;
–每天至少1个使用点取样,每周所有使用点都取样1次
纯化水PQ验证:
|
阶段 |
取样位置 |
取样频率 |
检测项目 |
监测标准 |
|
第一阶段 |
制备系统-原水罐 |
每月一次 |
国家饮用水标准规定项目 |
国家饮用水标准 |
|
制备系统-器械过滤器 |
每周一次 |
淤泥指数(SDI) |
小于4 |
|
|
制备系统-软化器 |
每周一次 |
硬度 |
小于1 |
|
|
制备系统-产水 |
每天 |
全检 |
药典或者内控标准 |
|
|
储罐和分配系统总进、总回取样口 |
每天 |
全检 |
药典或者内控标准 |
|
|
分配系统各用点取样口 |
每天 |
全检 |
药典或者内控标准 |
|
|
第二阶段 |
制备系统-原水罐 |
每月一次 |
国家饮用水标准 |
国家饮用水标准 |
|
制备系统-器械过滤器 |
每周一次 |
淤泥指数(SDI) |
小于4 |
|
|
制备系统-软化器 |
每周一次 |
硬度 |
小于1 |
|
|
制备系统-产水 |
每天 |
全检 |
药典或者内控标准 |
|
|
储罐和分配系统总进、总回取样口 |
每天 |
全检 |
药典或者内控标准 |
|
|
分配系统各用点取样口 |
每天 |
全检 |
药典或者内控标准 |
|
|
第三阶段 |
制备系统-原水罐 |
每月一次 |
国家饮用水标准 |
国家饮用水标准 |
|
制备系统-器械过滤器 |
每月一次 |
淤泥指数(SDI) |
小于4 |
|
|
制备系统-软化器 |
每月一次 |
硬度 |
小于1 |
|
|
制备系统-产水 |
每天 |
全检 |
药典或者内控标准 |
|
|
储罐和分配系统总进、总回取样口 |
每天 |
全检 |
药典或者内控标准 |
|
|
分配系统各用点取样口 |
每天取样,每月轮检一遍 |
全检 |
药典或者内控标准 |
注射用水PQ验证:
|
阶段 |
取样位置 |
取样频率 |
检测项目 |
监测标准 |
|
第一阶段 |
制备系统-供水 |
每周一次 |
纯化水药典规定项目 |
纯化水药典规定标准 |
|
制备系统-出水 |
每天 |
全检 |
药典或者内控标准 |
|
|
储罐分配系统总进、总回、最远取样口 |
每天 |
全检 |
药典或者内控标准 |
|
|
分配系统各用点取样口 |
每天 |
微生物、细菌内毒素—每天 理化项目-每周至少两次 |
药典或者内控标准 |
|
|
第二阶段 |
制备系统-供水 |
每周一次 |
纯化水药典规定项目 |
纯化水药典规定标准 |
|
制备系统-出水 |
每天 |
全检 |
药典或者内控标准 |
|
|
储罐分配系统总进、总回、最远取样口 |
每天 |
全检 |
药典或者内控标准 |
|
|
分配系统各用点取样口 |
每天 |
微生物、细菌内毒素—每天 理化项目-每周至少两次 |
药典或者内控标准 |
|
|
第三阶段 |
制备系统-产水 |
每周一次 |
全检 |
药典或者内控标准 |
|
储罐分配系统总进、总回、最远取样口 |
每天 |
全检 |
药典或者内控标准 |
|
|
分配系统各用点取样口 |
每周取样,每周所有点检验一遍 |
全检 |
药典或者内控标准 |
|
|
备注:若供水为纯化水,需要纯化水PQ第一阶段结束后,方可开始注射用水的PQ测试。 |
||||
2025上海医疗设备展Medtec指出,完善的文件系统—验证文件及验证支持文件为:
1、项目文件包 2、制造过程文件包(包括压力容器和管道系统) 3、功能规范( FS )、硬件设计规范( HDS )、软件设计规范( SDS ) 、PLC软件等 4、操作手册 5、维护手册 6、元器件数据表和子供应商手册 7、DQ文件包(方案、过程、结果、报告和支持性文件) 8、FAT文件包(方案、过程、结果、报告和支持性文件) 9、SAT文件包(方案、过程、结果、报告和支持性文件) 10、IQ/OQ文件包(方案、过程、结果、报告和支持性文件) 11、PQ方案、报告和支持性文件
FAT/SAT/IQ/OQ/PQ之间的关系。
—“确认”过程实际上就是对应于URS/FS/DS的一一对应的确认过程。
—对于不复杂的设备来说,FAT/SAT/IQ/OQ之间并无多大的区别,设备出厂之前制造商所要做的测试就是要满足FS功能要求的所有测试,当然要包括诸如连锁、报警、运行等测试。
—之所以要做SAT是因为要检查设备(包括控制系统)经过了装箱、长途运输、现场就位后,性能是否有偏离。
—对于不复杂的设计来说,SAT增加适当的测试项目后可以视为IQ/OQ,不必分开重复做。
日常监测
—在性能确认完成后,应对系统进行综合评价并根据第三阶段的结果建立一个日常监测方案。在日常取样监测中,使用点的取样频率比在性能确认中已确定的采取频率少;
—对于注射用水系统,必须保证每周所有的使用点都被检测到,在此条件下,每天取样的数量保持评估,关键的取样点需要根据工艺需要进行日常监测。这样,对于较大的分配系统,可以轮流采样保证每个采样点每周可以被采集一次;
—对于纯化水,其系统影响性风险较低,比注射用水的日常监测频率可适当降低;
—所有这些与日常监测的取样计划需要记录在SOP中。
—应当至少每年进行一次水系统质量回顾,系统年度审核可以帮助用户了解系统随时的变化趋势,还可以基于数据分析调整系统设定的报警限度和行动限度,甚至相关的SOP。
—系统质量回顾不能仅限于水质的取样结果,应该是系统的综合回顾,其中应包括:
系统图纸审查、相关的SOP;
系统确认和验证的状态审核;
系统预防性维护和故障检修记录审核;
系统关键偏差或异常和报警的审核;
系统日常监测数据结果、趋势的审核;
系统消毒程序的审核;
系统相关培训记录的审核;
2025上海医疗设备展Medtec现场将设四大专区,囊括电子光学、AI、IVD诊断及影像、检测、临床、法规、研发设计& 大动物实验专区等展品,点击此处报名参展>>>
定期维护
—应根据系统维护程序对制药用水系统进行维护,应该包括但不限于:维护项目、维护频率、不同部件的维护方法、维护记录、合格备用件的控制等。
—对系统进行定期维护后,可不必进行再验证,如有必要只需要进行水质检测。
—典型的维护工作有:储罐和输送管路的定期清洗和消毒;
阀门、垫片、呼吸器等易损部件的定期更换;
管道系统的压力试验、清洗钝化等;
水机多介质过滤器、活性炭过滤器、RO反渗透膜的彻底清洗及更换;
仪表的检查、校准及更换。
再验证
—要确保制药用水系统在整个周期内良好运行,需要在一定时间的运行后定期进行再验证,这应包括系统的使用定期性能评估结果,系统变更的性质和程度,系统未来预期使用的变更,以及企业合适的质量管理系统;
计划中应考虑的项目包括:
维护:系统常规的维护工作,比如说更换部件(非关键)、清洗等一般不需要再验证。
改造:改造一般包括更换“不同”部件,改变系统的配置或改变控制程序、运行参数等。更改如果不改变初始系统的设计目的,则或许不需要完整的再验证,再验证的程度取决于给系统带来的潜在影响。
设计变更:设计变更代表这对初始设计的重大改变,主要对系统进行再验证,例如,在一条纯化水生产线上增加一个去离子装置,这将会改变最终处理的效果,就需要比较复杂的再验证。
2025上海医疗设备展Medtec认为,系统性能不稳定,出现重大偏差,或导致关键部件更换,需要对系统进行再验证。
文章来源:












