2024上海医疗设备展Medtec讲解如何应对监管机构对安全性分析的要求:临床试验中6种分析不良事件AE的方法
2024-08-14
疗效和安全性是评估一个药物风险获益比的两个重要方面。当一个药物的疗效满足监管机构的要求时,安全性特征也要在合理范围内。但临床试验中有时候会出现一些很特殊且引起监管机构关注的不良反应。如PD-1/L1的irAE,BTKi的肝损伤,EGFRi的出血事件等。这种情况下,往往会需要申办方做一些更深入的分析来解析药物的安全性。2024上海医疗设备展Medtec基于过往的一些临床试验经验和文献,总结了6种申办方和监管机构可能要求的AE分析方法供大家参考。
1. 发生率
计算发生率是分析AE的基本要求。例如,整体发生率,按照PT、SOC的发生率,按照级别、导致药物暂停/终止治疗/死亡等的AE情况。
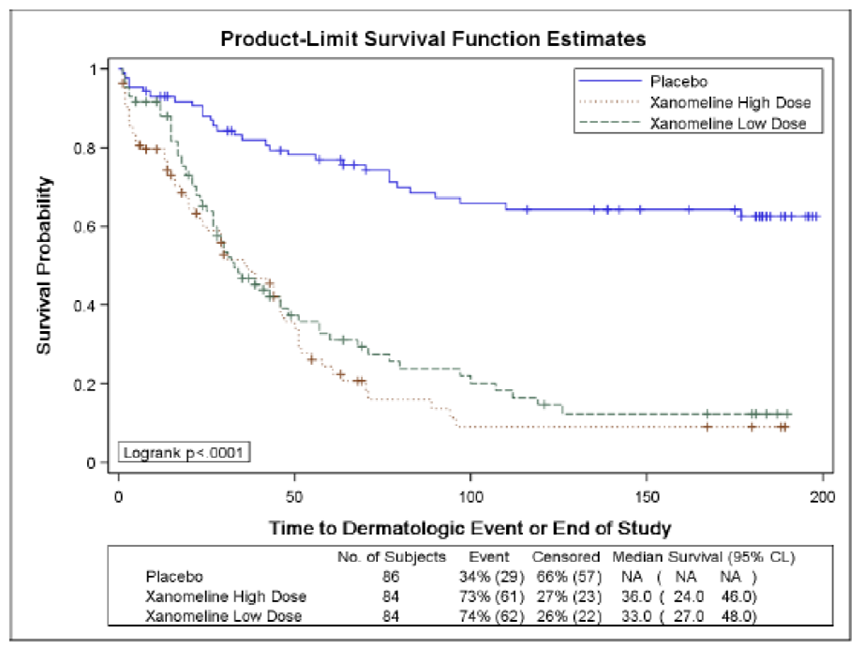
2. 至发生时间和持续时间
从服药开始至AE出现的时间与AE开始后的持续时间是AE的两个重要维度。如果AE一直持续,说明这一类AE在临床上持续较久,很可能需要申办方解释如何管理及保证或者的安全性,尤其是对于>=3级以上的AE,更值得关注。下表展示了一种常见的汇总格式。

来源:Kriss Harris et al. PhUSE 2017
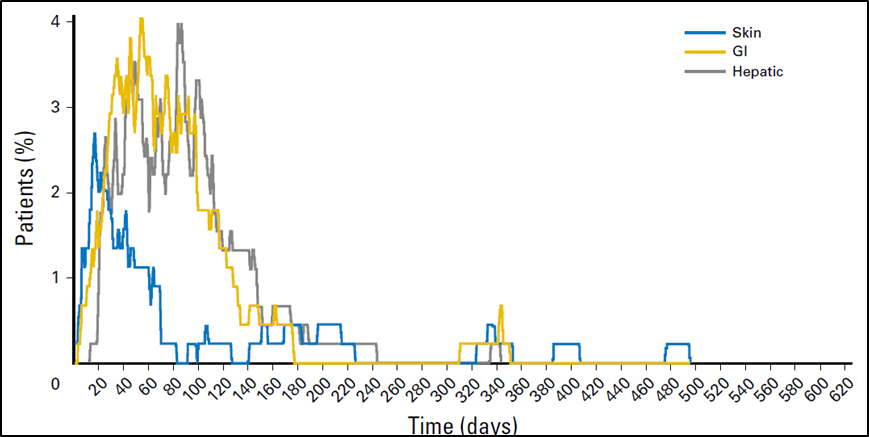
3. AE 的时间分布
按照不同的时间段看AE发生率的变化规律。例如,虽然AE发生较迅速,但是很快就会消失,甚至是一过性的,那么这种AE影响估计不大。如果在整个服药期间某一类都在持续出现,且CTCAE等级较高,则很可能是药物相关性AE,需要从临床角度考虑如何应对。
2024上海医疗设备展Medtec今年将重磅推出展前会——医疗器械设计与制造技术产业峰会 2024,由主论坛及4个分论坛组成。其中分论坛1:医疗器械公共政策及市场准入将邀请有关部门权威人士对以上各项法规进行探讨,以期帮助企业明确未来发展方向,并给出指导建议。如需报名参加展前会,敬请联系[email protected],上海医疗器械展会Medtec期待您的参与!您也可以报名参观,参与现场免费会议!
4. 结局转归汇总
AE的结局代表针对AE的干预是否有效,如果一直没有恢复,那么持续时间就会很长,也说明这一类AE有效干预难度较大。
5. AE 的影响因素分析
如果试验组的AE特别突出(例如,试验组出血事件明显更多、试验组死亡比例跟高),监管机构往往会要求分析其影响因素,如果能找到临床影响因素,那么就可以采取措施去进行控制,也说明AE是可预测的。
有时候在组间比较的时候为了减少时间因素的偏倚,可能会采用landmark分析策略,即排除掉过早终止治疗或死亡的患者。例如,排除掉2个月内终止治疗或死亡的患者。
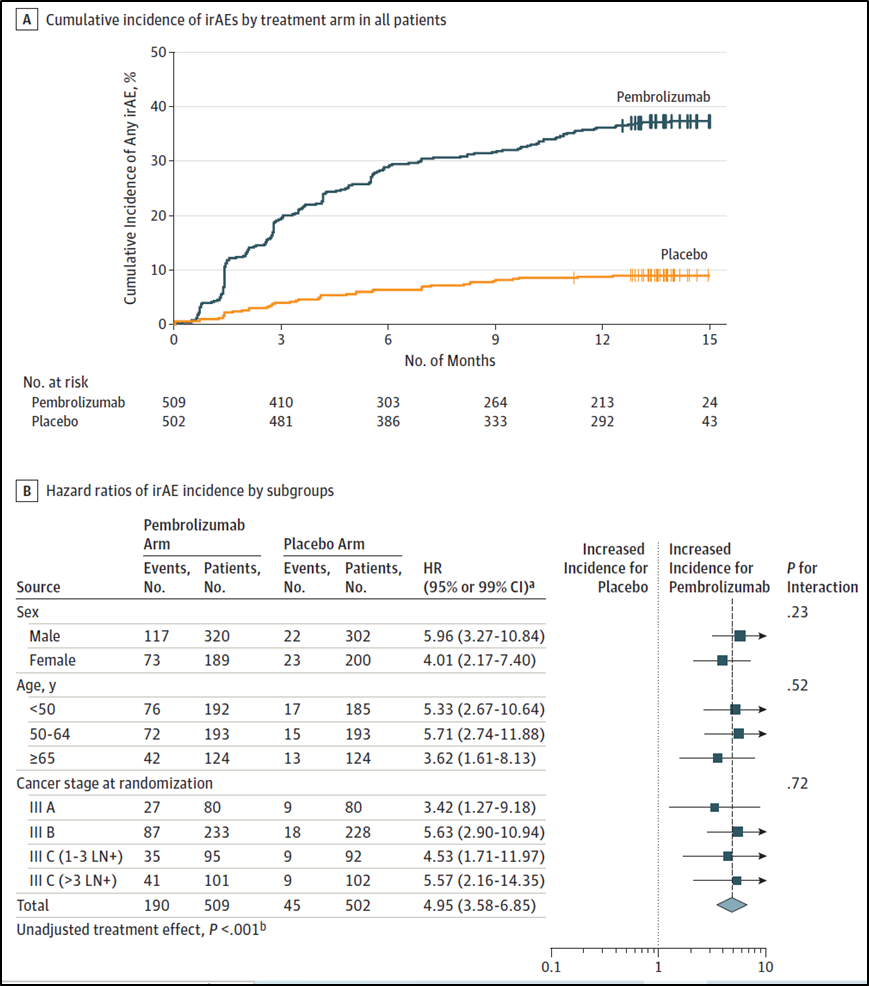
6. AE 发生风险比(HR)