中国医疗器械博览会|FDA|一文读懂FDA医疗器械分类和注册途径选择
2025-03-25
中国医疗器械博览会了解到,确定产品类别是启动医疗器械注册的第一步。了解FDA医疗器械的分类法规至关重要,不仅有助于制造商顺利将医疗器械产品引入美国市场,避免因分类错误导致的对注册时限、费用和资源的影响和损耗,以及可能面临的被扣货/拒绝入境/列入黑名单等风险,同时也有助于注册从业者学习和比较不同监管机构要求上的异同,拓展法规知识。
本文将从实战角度,介绍在FDA申报中判定医疗器械产品类别和注册途径的方法。
一、三步法原则
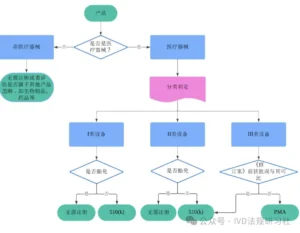
通过以下三个步骤,可以在绝大多数情况下轻松确定医疗器械产品在FDA的分类和注册途径,详见下图。
第1️⃣步:通过产品的预期用途和适应症判断产品是否属于医疗器械。
第2️⃣步:判定产品的类别,常用的有三种方法(见下文)。
第3️⃣步:判定产品的注册途径。I类和II类非豁免医疗器械需提交上市前通知申请,豁免医疗器械无需提交。III类医疗器械的申报路径通常为PMA;如果设备是在 1976年《医疗器械修正案》通过之前上市或者与此类设备实质等同,并且未被要求PMA,此种特殊情形下,可通过上市前通知进行申报。
图片来源:IVD法规研习社
二、判定产品类别和注册途径的三种常用方法
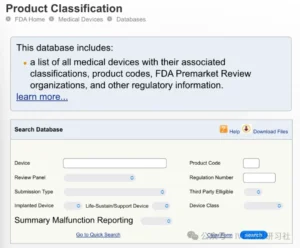
1、检索FDA产品分类数据库(Product Classification Database)
在数据库搜索页面,通过输入设备名称、产品代码(product code)或法规编号(regulation number)等关键词进行搜索。
图片来源:IVD法规研习社
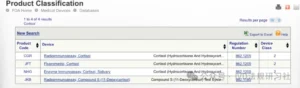
示例:输入设备名称“Cortisol”,检索出以下四种不同检测原理的皮质醇试剂。
图片来源:IVD法规研习社
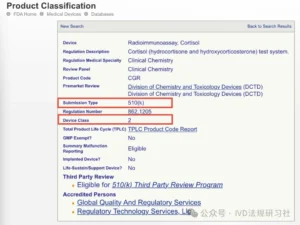
点击设备名称对应的链接,即可获知产品的分类、注册途径以及其他监管信息。以下为点击第一个放射免疫法皮质醇检测试剂的链接获得的结果,该产品为II类器械,注册途径为510(k)。
图片来源:IVD法规研习社
FDA已经对约1700种医疗器械按医学专业进行了分类,共分为16个专业领域,每类器械均有对应的监管法规条款,通过查找对应的法规可以确定产品分类。
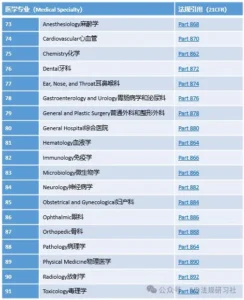
图片来源:IVD法规研习社
示例:点击《联邦法规》第21章第866部分对应的链接,进入以下细分的子章节。

图片来源:IVD法规研习社
选择对应的产品章节获取分类等监管信息。例如,点击“第866.3170章节 基于核酸的HCV检测试剂”,该产品在FDA的类别为II类器械。
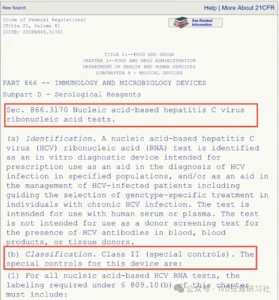
图片来源:IVD法规研习社
3、通过513(g)确定产品分类
如果根据上述方法仍无法确定产品分类,且希望获得由FDA提供的正式的医疗器械分类界定,可以向FDA提交513(g)申请。FDA 会为被咨询的产品提出分类和监管路径的建议。
FDA对513(g)的回应并不构成FDA许可或批准。如果递交了513(g)并且FDA对拟申报产品的监管途径做出回应,申请人应遵守被建议的路径,例如提交510(k)或PMA。
513(g)项目需要申请人支付用户费用。在2025财年(2024年10月1日至2025年9月30日),FDA对于513(g)申请的收费标准为:一般企业7301美元(约5.4万人民币),小微企业3650美元。相较于国内免费进行分类界定,这个收费标准还是很高的。
文章来源:IVD法规研习社
若涉及侵权,请立刻联系删除











