器械临床试验核查问题分析及常见问题汇总
2019-02-19
2019年已经正式拉开帷幕,回想过去的一年,我司接受了某省局、国家局对于临床试验两次监督抽查,小编与队友们回忆往昔,以切身经验为基础,对2016年至今2018年总局三年内的医疗器械临床抽检公告进行了总结。
一、硝烟弥漫的战场
2016年,CFDA抽取20个项目开展临床试验现场检查,8个存在真实性问题。
2017年,CFDA抽取19个项目开展临床试验现场检查,3个存在真实性问题。
2018年,截止目前,CFDA抽取20个项目开展临床试验现场检查,9个有合规性问题,未公布有真实性问题(请注意第二批10个项目结果尚未公布,但我司项目已传佳绩)。
各省局临床核查也已开展多年,如广东、北京、上海、江苏、广西、浙江、湖南、天津、辽宁、河南、安徽、四川、山西……
不幸的是:在核查通告中,我们不难发现IVD问题较多,是“重灾区”。
我们还发现:目前开展的临床试验监督抽查不仅关注的是在注册项目,还包括备案后现处于试验中的项目。
由此可见,监管部门对临床核查有着强大的决心、恒心、专心。
写到此,心情沉重,小编觉得“质量保证,准时交付”不仅是我们给客户、公司的承诺,更是我们部门给自己的“军令状”:
a)确保临床进度时,同时也要做好质量控制和质量保证;
b)法规要求绝不是“优秀线”,勉强算上“及格线”;
c)临床试验的质量不是操作出来的,而是设计出来的;
d)加强临床试验管理,才能保证试验规范,才能使得产品安全性和有效性可信,才能维护好受试者的权益。
二、临床试验质量控制法规依据
《医疗器械监督管理条例》的决定 (国令第680号)
《体外诊断试剂注册管理办法》(局令第5号)
《医疗器械注册管理办法》(局令第4号)
《医疗器械临床试验质量管理规范》(局令第 25号)
《体外诊断试剂临床实验指导原则》(2014年16号通告)
《体外诊断试剂临床试验指导原则(征求意见稿)》(2018年11月22日)
《医疗器械临床试验规定》(局令第5号)(废止)
《总局关于开展医疗器械临床试验监督抽查工作的通告》(2016年第98号)
《国家药监局综合司关于印发医疗器械临床试验检查要点及判定原则的通知》(药监综械注〔2018〕45号)
三、临床试验监督抽查内容
目前临床监督抽查主要是围绕临床试验的真实性和合规性开展。依据 2018年11月28日发布《医疗器械临床试验检查要点及判定原则》(药监综械注〔2018〕45号),根据检查发现的问题,检查结果按以下原则判定。
3.1 有以下情形之一的,判定为存在真实性问题:
(1)编造受试者信息、主要试验过程记录、研究数据、检测数据等临床试验数据,影响医疗器械安全性、有效性评价结果的;
(2)临床试验数据,如入选排除标准、主要疗效指标、重要的安全性指标等不能溯源的;
(3)试验用医疗器械不真实,如以对照用医疗器械替代试验用医疗器械、以试验用医疗器械替代对照用医疗器械,以及以其他方式使用虚假试验用医疗器械的;
(4)瞒报与临床试验用医疗器械相关的严重不良事件和可能导致严重不良事件的医疗器械缺陷、使用方案禁用的合并用药或医疗器械的;
(5)注册申请的临床试验报告中数据与临床试验机构保存的临床试验报告中的数据不一致,影响医疗器械安全性、有效性评价结果的;
(6)注册申请的临床试验统计分析报告中数据与临床试验统计数据库中数据或分中心临床试验小结中数据不一致,影响医疗器械安全性、有效性评价结果的;
(7)其他故意破坏医疗器械临床试验数据真实性的情形。
3.2 未发现真实性问题的,但临床试验过程不符合医疗器械临床试验相关规定要求的,判定为存在合规性问题。
3.3 未发现上述问题的,判定为符合要求。
四、监督抽查总结
下图是2016~2018年临床监督抽查公告中的常见问题分析。其中“核心文件”的整理是最令人头疼的,此外,“物资管理”、“试验数据”也是临床真实性核查中最常见的问题。
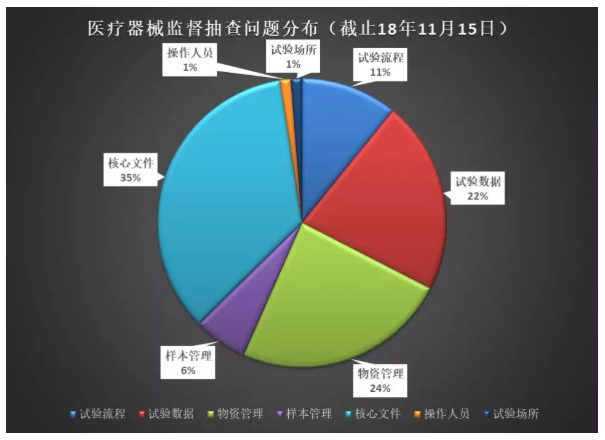
“核心文件”——药监局是有发目录清单的(总局关于发布《医疗器械临床试验伦理审查申请与审批表范本》等六个文件的通告(2016年第58号):附件6.医疗器械临床试验应当保存的基本文件目录)。文件工作是最基本的工作,实际检查出来的情况确让人堪忧。如果连“文件工作”都做不好,药监局的老师们如何相信临床试验的合规性、真实性呢?
基于此,也请大家延伸思考2个问题:
a) 每一个临床试验参与者,会不会是另一个临床试验的受试者呢?
b) 每一个临床试验参与者,会不会又是另一个产品经过临床试验并被批准上市的最终使用者呢?
“物资管理”和“试验数据”——均可以通过文件和记录体现。《医疗器械临床试验质量管理规范(25号令)》要求如下:
第78条所述“临床试验结束时,研究者应当确保完成各项记录、报告。同时,研究者还应当确保收到的试验用医疗器械与所使用的、废弃的或者返还的数量相符合,确保剩余的试验用医疗器械妥善处理并记录存档”;
第80条所述“在临床试验中,研究者应当确保将任何观察与发现均正确完整地予以记录,并认真填写病例报告表”;
第82条所述“申办者应当准确、完整地记录与临床试验相关的信息”。
通告中显示不少项目缺失研究产品“交接记录”、“运输记录”、“储存条件”、“分发记录”、“使用记录”、“回收/销毁记录”,甚至还有记录显示试验用样本“已经超过有效期”,我们不禁要问“真的有做过临床试验吗?”
另外,同一个项目在不同临床试验机构被检查出的问题基本是一致的。究其根本原因,需要考虑下是否是——临床试验申办方及其代表(如CRO)对于临床试验态度的问题了——有些文件不是有就行了,如果忽略了时间关系和逻辑顺序,那么低级错误就会频繁发生。
随着监管力度越严,如果大家还是抱有侥幸心理并企图蒙混过关,总有一天会自食恶果,因为“出来混终是要还的”。
小编在工作中无意发现,有些机构老师根据通告做了《申办方与医院“黑名单”》,声称不与他们合作。碰到这种中心,小编认为还是应该好好珍惜,当以自勉,互相学习,早日进步为宜。
五、通告案例问题归纳
5.1 临床试验机构方面
未经审核同意在临床试验机构以外场所进行试验。
5.2 临床试验中实施者/申请人的职责履行情况
有非临床试验机构人员参与试验设备操作。
5.3 临床试验的批准备案情况
(1) 研究者未全程参与临床试验方案的制定过程;
(2) 临床试验方案修订未经医院伦理委员会、申办方、主要研究者批准;
(3) 方案无主要研究者、统计学负责人签字或无机构盖章;
(4) 方案无临床试验主管部门意见、盖章。
5.4 伦理审查方面
(1) 伦理委员会批准的知情同意书、CRF内容与执行的知情同意书、CRF内容不一致;
(2) 需要快审资料,未提供主审委员的快审审查意见;
(3) 伦理批件未见伦理委员会会议签到表;
(4) 伦理批件未标明临床试验方案和知情同意书的版本号;
(5) 知情同意书中缺少风险告知内容;
(6) 无合理理由家属代签知情同意书。
5.5 临床试验准备情况
(1) 未按照试验用医疗器械的预期用途进行方案设计;
(2) 临床试验方案编制不严谨,前后不一致或者相互矛盾;
(3) 《医疗器械临床试验须知》中无受试产品的技术指标等;
(4) 病例未按照统计学原理进行选取,且抽查病例的干扰病例指标无法溯源;
(5) 未根据临床试验方案制定标准操作规程;
(6) 未提供临床试验质控品交接和检测记录;
(7) 未提供对照产品的相关资质文件;
(8) 多中心试验中,参比试剂不同;
(9) 临床试验记录、表格、文件等资料未签署具体意见或未盖章。
5.6 临床试验实施情况
(1) 未严格按照制定的临床试验方案开展试验;
(2) 受试者入组前未按方案要求完成全部检测;
(3) 未开展预实验;
(4) 监查方案可操作性不强,未能在监查中及时发现问题。
(5) 未记录合并用药;
(6) 临床试验样本的存储条件与实际不一致;
(7) 对比试剂的适用机型与试验用仪器不符。
5.7 临床试验数据管理
(1) 原始病历中相关记录不全;
(2) 临床试验相关图像评估记录不全;
(3) 病例临床试验原始记录未记录修改原因和时间;
(4) 样本无筛选记录;
(5) 项目培训记录不完全或缺失;
(6) 监查记录不完全或缺失;
(7) 病例报告表记录不符合要求;
(8) 病例报告表表中数据与原始记录不一致;
(9) 临床试验检测数据无操作者、复核者签字确认等;
(10) 漏报不良事件、严重不良事件、器械缺陷等;
(11) 剔除数据无依据和说明;
(12) 未记录受试产品的失效日期等;
(13) 临床试验用设备使用记录缺失。
5.8受试产品的管理
(1) 通过现场检查和调取注册申请资料还发现,该注册申请项目在开展临床试验前未提交该产品的型式试验报告;
(2) 未提供受试产品、对照产品的分发和回收记录;
(3) 仪器交接记录未保留快递单号;
(4) 试验用样本试剂交付给临床试验机构时已经超过有效期。
5.9 临床试验用样本的管理
(1) 样本重复使用,未提供相应说明;
(2) 样本采集、储存、分发、使用、留样、销毁记录不完全或缺失;
(3) 样本类型不符、无法追溯。
5.10 申报资料的情况
(1) 伦理委员会保存的方案与注册申报材料中的方案病例数和病例分配不一致;
(2) 提交的注册申请中的临床试验方案、报告与临床试验机构保存的临床试验方案、报告签章不一致;
(3) 临床试验用产品与注册申报资料的临床试验方案和试验报告中的产品为不一致;
(4) 部分临床数据与现场提供的统计分析数据不一致等;
(5) 统计分析报告表未对剔除病例做出说明等;
(6) 临床机构保存的可溯源的随访例数与注册申报资料的临床试验总结报告随访例数不一致。
小结:限于篇幅问题,小编就先写到这了。临床试验现场核查目前只是刚刚拉开帷幕,作为正在或即将踏上临床试验征途的法规工作者,我们要“冬练三九,夏练三伏”,稳扎稳打,放眼全局。在进行临床试验时,我们要保证质量,不要一味的追求进度而忽视质量,要遵循产品的自身特点和预期用途,要遵循相关法律法规和相关的SOP要求,否则必将前功尽弃、玩火自焚。
以上内容只是小编的几点薄见,如若存在错误的地方,欢迎批评指正。












