欧美澳加口罩出口法规要求概览
2020-03-06
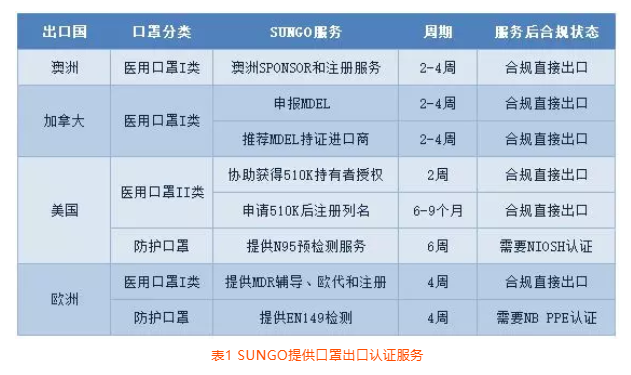
清晰预见。为应对近两天广大客户关于口罩出口认证的问询,SUNGO整理相关国家和地区法规要求以及我们可以提供的服务内容。摘要见表1。
表1 SUNGO提供口罩出口认证服务
欧洲市场
欧洲市场对于口罩的管理分为两个主要类别,个人防护口罩和医用口罩。个人防护口罩主要是工业用防护,医用口罩主要是医院使用。
1
医用口罩
医用口罩对应的欧洲标准是EN14683,该标准对于口罩的分类如下图所示,按照BFE、呼吸阻抗和防喷溅能力分为三个类别,具体指标见表2。
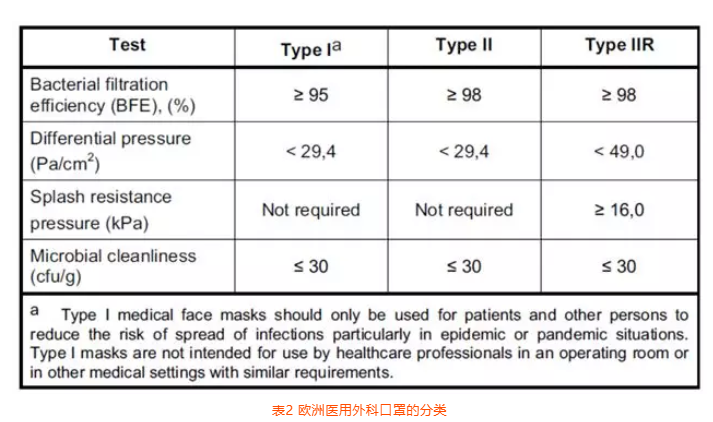
表2 欧洲医用外科口罩的分类
按照医疗器械法规2017/745/EU的要求,口罩产品可以按照一类器械进行管理。依据产品是无菌或非无菌状态提供,其认证模式不一样。
1.非无菌方式提供
1)编制技术文件
2)提供测试报告(可以提供熔喷布性能测试报告和无纺布的生物学报告)
3)编制DOC
4)指定欧盟授权代表并完成欧洲注册
2.无菌方式提供
1)灭菌验证
2)建立ISO13485体系
3)编制技术文件
4)提供测试报告(口罩本身的生物学、性能、无菌等测试报告)
5)公告机构审核(目前只能按照MDR审核,预计近期没有NB可以审核)
6)获CE证书
7)指定欧盟授权代表并完成欧洲注册
从目前整体情况来看,如果之前没有获得公告机构的CE证书,现在临时去申请已经没有可能性,因此目前出口到欧洲的口罩产品应该只有非无菌状态提供一个选项。但是非无菌并不是对生产环境完全不控制,EN14683对于产品的初始污染菌要求不大于30cfu/g。
2
防护口罩
防护口罩的欧洲标准是EN149,按照标准将口罩分为FFP1/FFP2和FFP3三个类别,具体的指标见表3。
防护口罩需要满足欧盟个人防护设备指令(PPE)的要求,防护口罩属于其中复杂设计的产品。出口欧洲需要授权的公告机构进行认证并颁发证书,认证需要的资料包括:
A)产品的型式试验报告;
B)技术文件评审
C)工厂质量体系审查。
Part.2
美国市场
美国法规对医用口罩和工业防护口罩同样是区分管理,其中医用口罩由FDA管控,而防护口罩则由NIOSH管控。大家熟知的N95口罩就来源于NIOSH对口罩分类中的一个类别。
1
医用口罩
美国对于医用口罩的管理机构是FDA,在FDA系统中对于口罩的分类代码有如下3个。其中一个是外科口罩,一个是儿科口罩,一个是带有抗菌/抗病毒介质的外科口罩,见图1。
图1 美国FDA分类数据库中的口罩
三个类别的口罩都属于规则878.4040,分类都是II类,都需要申请510K批准。那么我们正常出口美国的口罩必须的路径为:
1)进行产品测试(性能测试、生物学测试)
2)准备510K文件,提交FDA评审
3)FDA发510K批准信
4)完成工厂注册和器械列名
5)产品出口
但是该过程至少需要半年以上时间。那是否有其他可选方法呢?SUNGO咨询师经过分析提供两种其他可选路径:
(1)已经获得NIOSH批准的N95口罩可以直接注册
图2 878.4040的释义
从图2可以看出,如果你的N95口罩获得了NIOSH的批准,生物学测试、阻燃测试和血液穿透测试都通过了,那么你是可以豁免510K的,可以直接进行工厂注册和器械列名。
(2)获得持有510K的制造商的授权,作为其代工厂使用其510K批准号进行企业注册和器械列名。申请方需要获得授权书,需要签署正式的质量协议,FDA会进行核实和抽查。如果使用未经许可的号码,将会导致产品召回的风险。
2
防护口罩
NIOSH将口罩分成N95、N99、N100、R95、R99、R100、P95、P99、P100合计9个类别。从某种意义上来说,N95算是其中防护级别比较低的品类。
NIOSH的口罩防护等级认证程序复杂,包括:
送样品到NIOSH认可的实验室进行预检,通常是美国实验室;
编写技术文件提交NIOSH评审,通常包括:
✰ 产品图纸
✰ 产品说明
✰ 质量体系文件
✰ 测试报告
工厂检查
核发证书
Part.3
澳洲市场
澳洲的医用口罩按照I类管理,需要在TGA进行备案之后可以销售。当然在澳洲的备案需要由澳洲当地的SPONSOR来完成,其合规流程为:
1)指定SPONSOR(SUNGO 澳洲可以提供服务)
2)完成技术文档
3)提交TGA进行备案
4)获得证书(见图3)
图3 TGA注册证书
Part.4
加拿大
加拿大医疗器械产品分为4类,其中1类风险最低,不需要做器械注册(MDL),只需要进行MDEL(制造商注册),见图4。
图4 加拿大医疗器械管理示意图
加拿大的口罩产品属于I类医疗器械进行管控,按照其法规如果是中国制造商,可以选择:
1)申请MDEL证书自行出口
2)找到加拿大持有MDEL证书的进口商交易
申请MDEL需要完成申请表的如下内容,提交后2-4周可以获得证书。
(1)公司名称及联系方式
(2)许可文件、邮寄和帐单地址
(3)分类和活动表
(4)场地地址
(5)制造商信息
(6)证明
(7)签名












